Forskere udvikler ny biomimetisk formulering til behandling af glioblastom
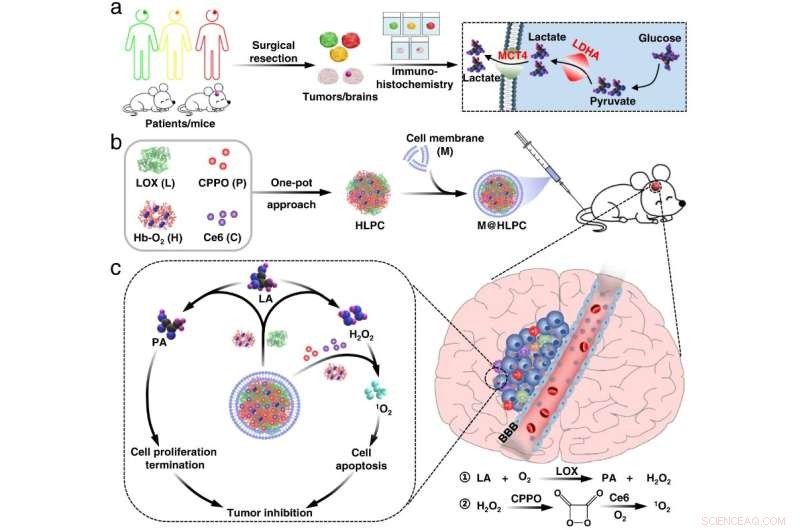
Fig. 1 Fremstilling af biomimetisk formulering og tumorhæmningsmekanisme. Kredit:Lu Guihong
Glioblastoma multiforme (GBM) er en aggressiv hjernekræft med en dårlig prognose og få behandlingsmuligheder. Der er derfor et presserende behov for nye og effektive tilgange til GBM-behandling.
Baseret på observation af forhøjet laktat i resekeret GBM, har forskere fra Institute of Process Engineering (IPE) fra det kinesiske videnskabsakademi og Shenzhen Second People's Hospital udviklet en biomimetisk formulering, der bruger målrettede leveringsmidler til laktatmetabolisme-baseret synergistisk terapi mod GBM.
Undersøgelsen blev offentliggjort i Nature Communications den 21. juli.
Målretning af laktatmetabolisme er en attraktiv tumorterapeutisk strategi. Der er dog ingen rapporter, der direkte udnytter laktatmetabolismen til GBM-behandlinger. En begrænsning er eksistensen af blod-hjerne-barrieren, som forhindrer de fleste lægemiddelmolekyler (inklusive dem, der forstyrrer laktatmetabolismen) i at nå hjernen.
I betragtning af kompleksiteten og de infiltrerende egenskaber af GBM er det meget usandsynligt, at lactatmetabolisk monoterapi effektivt eliminerer GBM-celler. Derfor er det afgørende at udvikle synergistiske strategier for at øge den terapeutiske effektivitet af laktatmetabolisk terapi.
I denne undersøgelse indsamlede forskerne gliomprøver fra en stor kohorte af patienter og kvantificerede de laktatmetaboliske indikatorer LDHA og MCT4 og en repræsentativ spredningsmarkør Ki67.
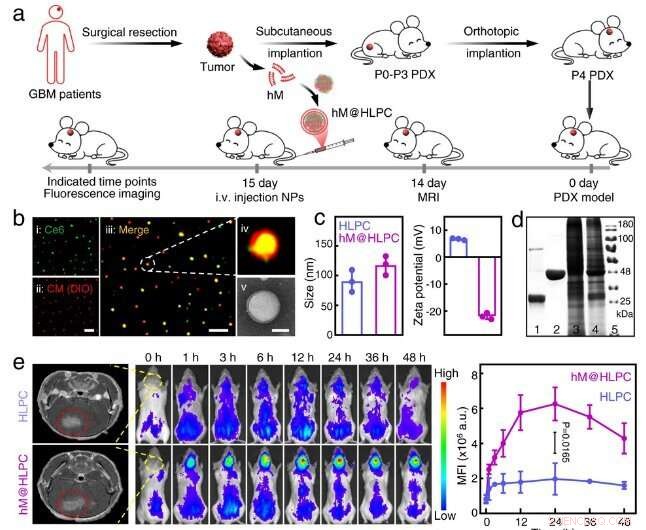
Fig. 2 Evaluering af den synergistiske terapeutiske effekt af personlig biomimetisk formulering i PDX-model. Kredit:Lu Guihong
"Vi observerede en positiv sammenhæng mellem lactatmetaboliske indikatorer og omfanget af gliomproliferation," sagde prof. Li Weiping fra Shenzhen Second People's Hospital. Således blev en effektiv metabolisme-baseret synergistisk terapi foreslået, som direkte ville udnytte det forhøjede laktat i GBM.
Forskerne fremstillede selvsamlende nanopartikler (NP'er) sammensat af hæmoglobin (Hb), lactatoxidase (LOX), bis[2,4,5-trichlor-6-(pentyloxycarbonyl)phenyl]oxalat (CPPO) og chlor e6 (Ce6) ) ved at bruge en one-pot tilgang. De indkapslede efterfølgende disse selvsamlede NP'er med membranmaterialer fremstillet af U251 gliomceller for at generere det biomimetiske M@HLPC-system. Dette designkoncept var i stand til at opnå målrettet levering til kombinationsterapi.
"Efter intravenøs injektion kunne M@HLPC krydse blod-hjernebarrieren via transcytose fra integrin og vaskulær celleadhæsion-protein-medieret genkendelse og derefter akkumuleret i GBM gennem homotypisk genkendelse baseret på cellegenkendelsesfunktion-associerede proteiner, " sagde prof. Wei Wei fra IPE.
I tumorer omdannede LOX i NP'erne laktat til pyrodruesyre og hydrogenperoxid (H2 O2 ). Pyrodruesyren hæmmede cancercellevækst ved at blokere histonekspression og inducere cellecyklusstandsning. Parallelt hermed er H2 O2 fungerede som et lokalt brændstof til at reagere med den leverede CPPO for at frigive energi, som derefter kunne bruges af den co-leverede fotosensibilisator Ce6 til generering af cytotoksisk singlet oxygen til at dræbe gliomceller.
Potent terapeutisk effekt blev bekræftet i både cellelinje-afledte xenograft- og patient-afledte xenograft (PDX) tumormodeller.
"I betragtning af formuleringens sikkerhed og de potente terapeutiske virkninger mod den matchede PDX-model, har vores personlige biomimetiske formulering potentialet til at oversætte til klinisk anvendelse," sagde prof. Ma Guanghui fra IPE. + Udforsk yderligere
Live overvågning af hjernemetabolisme med fluorescens
 Varme artikler
Varme artikler
-
 Forskere bygger en transistor fra et molekyle og et par atomerScanning af tunnelmikroskopbillede af et phthalocyaninmolekyle centreret i en sekskant samlet fra tolv indiumatomer på en indiumarsenidoverflade. De positivt ladede atomer tilvejebringer den elektrost
Forskere bygger en transistor fra et molekyle og et par atomerScanning af tunnelmikroskopbillede af et phthalocyaninmolekyle centreret i en sekskant samlet fra tolv indiumatomer på en indiumarsenidoverflade. De positivt ladede atomer tilvejebringer den elektrost -
 Tsunami i nanoskala hjælper græshopper med at tune indØrkengræshoppe (Schistocerca gregaria) lægger æg under græshoppeudbruddet i 1994 i Mauretanien (fotograferet af Christiaan Kooyman). Kredit:Christiaan Kooyman / Wikipedia. Den bemærkelsesværdige m
Tsunami i nanoskala hjælper græshopper med at tune indØrkengræshoppe (Schistocerca gregaria) lægger æg under græshoppeudbruddet i 1994 i Mauretanien (fotograferet af Christiaan Kooyman). Kredit:Christiaan Kooyman / Wikipedia. Den bemærkelsesværdige m -
 Lab låser op for hemmeligheder bag 3D-print i nanoskalaLLNL-forskere kan udskrive træstabelgitter med submikron-træk en brøkdel af bredden af et menneskehår. Kredit:Jacob Long og Adam Connell/LLNL Lawrence Livermore National Laboratory (LLNL) forske
Lab låser op for hemmeligheder bag 3D-print i nanoskalaLLNL-forskere kan udskrive træstabelgitter med submikron-træk en brøkdel af bredden af et menneskehår. Kredit:Jacob Long og Adam Connell/LLNL Lawrence Livermore National Laboratory (LLNL) forske -
 Udvikling af nye teknikker til at forbedre atomkraftmikroskopiKemisk signal produceret af en 4 nm tyk polymerfilm opsamlet ved hjælp af tidligere afbøjning AFM-IR-detektion, top, sammenlignet med den nye null-afbøjning tilgang. Kredit:Beckman Institute for Advan
Udvikling af nye teknikker til at forbedre atomkraftmikroskopiKemisk signal produceret af en 4 nm tyk polymerfilm opsamlet ved hjælp af tidligere afbøjning AFM-IR-detektion, top, sammenlignet med den nye null-afbøjning tilgang. Kredit:Beckman Institute for Advan
- Sollys nedbryder polystyren hurtigere end forventet
- Anvendelse af statistisk metode viser lovende afbødende virkninger på klimaændringer på fyr
- Kobber og PTFE holder sammen for at understøtte bedre 5G
- Gør ski stærke nok til at olympierne kan køre på
- Koraller fra tusmørkezonen:Hvem spiser hvad på et dybt rev i Rødehavet
- Undslippe monstrene brøler:En amerikansk orkanoverlevende historie


