Hvordan forskellige kræftceller reagerer på lægemiddelleverende nanopartikler
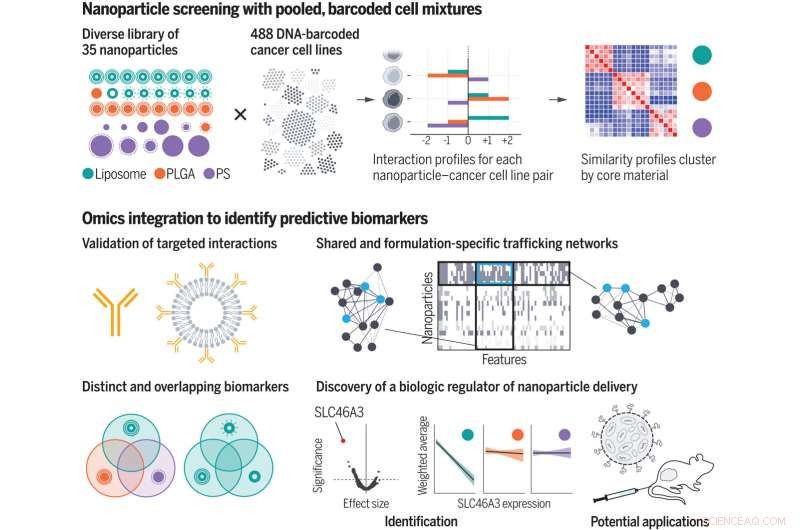
Ved hjælp af et kurateret nanopartikelbibliotek screenede forskerne nanopartikel-celle-interaktionsprofiler for hundredvis af kræftceller samtidigt. Ved at inkorporere omics-annotering identificerede de biologiske egenskaber eller biomarkører, der medierer levering af nanopartikler til celler. De genererede menneskehandelsnetværk og opdagede en biologisk regulator af lipid-baseret nanopartikellevering. PLGA, polylactid-co-glycolid; PS, polystyren. Kredit:Natalie Boehnke et al., Science (2022). DOI:10.1126/science.abm5551
Brug af nanopartikler til at levere kræftlægemidler tilbyder en måde at ramme tumorer med store doser af lægemidler og samtidig undgå de skadelige bivirkninger, der ofte følger med kemoterapi. Men indtil videre er kun en håndfuld nanopartikel-baserede kræftlægemidler blevet godkendt af FDA.
En ny undersøgelse fra MIT og Broad Institute of MIT og Harvard-forskere kan hjælpe med at overvinde nogle af forhindringerne for udviklingen af nanopartikelbaserede lægemidler. Holdets analyse af interaktionerne mellem 35 forskellige typer af nanopartikler og næsten 500 typer kræftceller afslørede tusindvis af biologiske egenskaber, der påvirker, om disse celler optager forskellige typer nanopartikler.
Resultaterne kunne hjælpe forskerne med bedre at skræddersy deres partikler til lægemiddellevering til specifikke kræfttyper eller designe nye partikler, der drager fordel af de biologiske egenskaber ved bestemte typer kræftceller.
"Vi er begejstrede for vores resultater, fordi det egentlig kun er begyndelsen - vi kan bruge denne tilgang til at kortlægge, hvilke typer af nanopartikler der er bedst til at målrette mod bestemte celletyper, fra kræft til immunceller og andre former for sunde og syge organceller. Vi lærer, hvordan overfladekemi og andre materialeegenskaber spiller en rolle i målretning," siger Paula Hammond, professor ved MIT Institute, leder af Institut for Kemiteknik og medlem af MIT's Koch Institute for Integrative Cancer Research.
Hammond er seniorforfatter til den nye undersøgelse, som vises i Science . Avisens hovedforfattere er Natalie Boehnke, en MIT postdoc, som snart vil slutte sig til fakultetet ved University of Minnesota, og Joelle Straehla, Charles W. og Jennifer C. Johnson Clinical Investigator ved Koch Institute, en instruktør ved Harvard Medical School, og en pædiatrisk onkolog ved Dana-Farber Cancer Institute.
Celle-partikel-interaktioner
Hammonds laboratorium har tidligere udviklet mange typer nanopartikler, der kan bruges til at levere lægemidler til celler. Undersøgelser i hendes laboratorium og andre har vist, at forskellige typer kræftceller ofte reagerer forskelligt på de samme nanopartikler. Boehnke, som studerede kræft i æggestokkene, da hun kom til Hammonds laboratorium, og Straehla, som studerede hjernekræft, bemærkede også dette fænomen i deres studier.
Forskerne antog, at biologiske forskelle mellem celler kunne være årsag til variationen i deres reaktioner. For at finde ud af, hvad disse forskelle kunne være, besluttede de at forfølge en storstilet undersøgelse, hvor de kunne se på et stort antal forskellige celler, der interagerer med mange typer nanopartikler.
Straehla havde for nylig lært om Broad Institutes PRISM-platform, som var designet til at give forskere mulighed for hurtigt at screene tusindvis af lægemidler på hundredvis af forskellige kræfttyper på samme tid. Med instrumentelt samarbejde fra Angela Koehler, en MIT-lektor i biologisk ingeniørvidenskab, besluttede holdet at forsøge at tilpasse denne platform til at screene celle-nanopartikel-interaktioner i stedet for celle-lægemiddel-interaktioner.
"Ved at bruge denne tilgang kan vi begynde at tænke på, om der er noget ved en celles genotypiske signatur, der forudsiger, hvor mange nanopartikler den vil optage," siger Boehnke.
Til deres screening brugte forskerne 488 kræftcellelinjer fra 22 forskellige oprindelsesvæv. Hver celletype er "stregkodet" med en unik DNA-sekvens, der gør det muligt for forskere at identificere cellerne senere. For hver celletype er omfattende datasæt også tilgængelige på deres genekspressionsprofiler og andre biologiske karakteristika.
På nanopartikelsiden skabte forskerne 35 partikler, som hver havde en kerne bestående af enten liposomer (partikler lavet af mange fedtmolekyler kaldet lipider), en polymer kendt som PLGA eller en anden polymer kaldet polystyren. Forskerne har også belagt partiklerne med forskellige typer beskyttende eller målrettede molekyler, herunder polymerer som polyethylenglycol, antistoffer og polysaccharider. Dette gjorde det muligt for dem at studere indflydelsen af både kernesammensætningen og overfladekemien af partiklerne.
I samarbejde med Broad Institute-forskere, herunder Jennifer Roth, direktør for PRISM-laboratoriet, udsatte forskerne puljer af hundredvis af forskellige celler for en af 35 forskellige nanopartikler. Hver nanopartikel havde et fluorescerende mærke, så forskerne kunne bruge en cellesorteringsteknik til at adskille cellerne baseret på, hvor meget fluorescens de afgav efter en eksponering på enten fire eller 24 timer.
Baseret på disse målinger blev hver cellelinje tildelt en score, der repræsenterer dens affinitet for hver nanopartikel. Forskerne brugte derefter maskinlæringsalgoritmer til at analysere disse scores sammen med alle de andre biologiske data, der er tilgængelige for hver cellelinje.
Denne analyse gav tusindvis af funktioner, eller biomarkører, forbundet med affinitet for forskellige typer nanopartikler. Mange af disse markører var gener, der koder for det cellulære maskineri, der er nødvendigt for at binde partikler, bringe dem ind i en celle eller behandle dem. Nogle af disse gener var allerede kendt for at være involveret i handel med nanopartikler, men mange andre var nye.
"Vi fandt nogle markører, som vi forventede, og vi fandt også meget mere, som virkelig har været uudforsket. Vi håber, at andre mennesker kan bruge dette datasæt til at hjælpe med at udvide deres syn på, hvordan nanopartikler og celler interagerer," siger Straehla.
Partikeloptagelse
Forskerne valgte en af de biomarkører, de identificerede, et protein kaldet SLC46A3, til yderligere undersøgelse. PRISM-screeningen havde vist, at høje niveauer af dette protein korrelerede med meget lav optagelse af lipid-baserede nanopartikler. Da forskerne testede disse partikler i musemodeller af melanom, fandt de den samme sammenhæng. Resultaterne tyder på, at denne biomarkør kunne bruges til at hjælpe læger med at identificere patienter, hvis tumorer er mere tilbøjelige til at reagere på nanopartikel-baserede behandlinger.
Nu forsøger forskerne at afdække mekanismen for, hvordan SLC46A3 regulerer optagelsen af nanopartikler. Hvis de kunne opdage nye måder at reducere cellulære niveauer af dette protein, kunne det hjælpe med at gøre tumorer mere modtagelige for lægemidler, der bæres af lipid-nanopartikler. Forskerne arbejder også på yderligere at udforske nogle af de andre biomarkører, de fandt.
Denne screeningstilgang kunne også bruges til at undersøge mange andre typer nanopartikler, som forskerne ikke så på i denne undersøgelse.
"Himlen er grænsen i forhold til, hvad andre uopdagede biomarkører er derude, som vi bare ikke har fanget, fordi vi ikke har screenet dem," siger Boehnke. "Forhåbentlig er det en inspiration for andre at begynde at se på deres nanopartikelsystemer på samme måde." + Udforsk yderligere
Ingeniører udvikler nanopartikler, der krydser blod-hjerne-barrieren
Denne historie er genudgivet med tilladelse fra MIT News (web.mit.edu/newsoffice/), et populært websted, der dækker nyheder om MIT-forskning, innovation og undervisning.
 Varme artikler
Varme artikler
-
 Ingeniører producerer den mindste 3D-transistor endnuVed at bruge en ny fremstillingsteknik, MIT forskere fremstillede en 3-D transistor mindre end halvdelen af bredden af nutidens slankeste kommercielle modeller, som kunne hjælpe med at proppe lang
Ingeniører producerer den mindste 3D-transistor endnuVed at bruge en ny fremstillingsteknik, MIT forskere fremstillede en 3-D transistor mindre end halvdelen af bredden af nutidens slankeste kommercielle modeller, som kunne hjælpe med at proppe lang -
 Ingeniører metallisk træ har styrken af titanium og tætheden af vandEn mikroskopisk prøve af forskernes metalliske træ. Dens porøse struktur er ansvarlig for dens høje styrke-til-vægt-forhold, og gør det mere beslægtet med naturlige materialer, som træ. Kredit:Univers
Ingeniører metallisk træ har styrken af titanium og tætheden af vandEn mikroskopisk prøve af forskernes metalliske træ. Dens porøse struktur er ansvarlig for dens høje styrke-til-vægt-forhold, og gør det mere beslægtet med naturlige materialer, som træ. Kredit:Univers -
 Ny elektronmikroskopi tilbyder nanoskala, skadefri isotopsporing i aminosyrerElektrificerende neutroner:Monokromeret elektronenergitabspektroskopi i det scannende transmissionselektronmikroskop bruges til at skelne mellem molekyler, der kun adskiller sig ved en enkelt neutron
Ny elektronmikroskopi tilbyder nanoskala, skadefri isotopsporing i aminosyrerElektrificerende neutroner:Monokromeret elektronenergitabspektroskopi i det scannende transmissionselektronmikroskop bruges til at skelne mellem molekyler, der kun adskiller sig ved en enkelt neutron -
 Forskere gør fleksible, lavspændingskredsløb ved hjælp af nanokrystallerDette er et fleksibelt kredsløb fremstillet i Kagan-laboratoriet. Kredit:David Kim og Yuming Lai (Phys.org)—Elektroniske kredsløb er typisk integreret i stive siliciumwafers, men fleksibilitet åbn
Forskere gør fleksible, lavspændingskredsløb ved hjælp af nanokrystallerDette er et fleksibelt kredsløb fremstillet i Kagan-laboratoriet. Kredit:David Kim og Yuming Lai (Phys.org)—Elektroniske kredsløb er typisk integreret i stive siliciumwafers, men fleksibilitet åbn
- Hvem har din ryg i en nødsituation?
- Nanoteknologi kan føre til ny behandling af leverkræft
- Klatring af stigen til livssøgning
- En biologisk tilgang til præcisionsmedicin retter sig mod et uendeligt antal sygdomme
- Overdimensionerede vindmøller genererer ren energi - og overraskende fysik
- Antarktiske smeltevandsstrømme kaster lys over mangeårige hydrologiske mysterium


