Nanoteknologi til genomredigering i flere muskler samtidigt
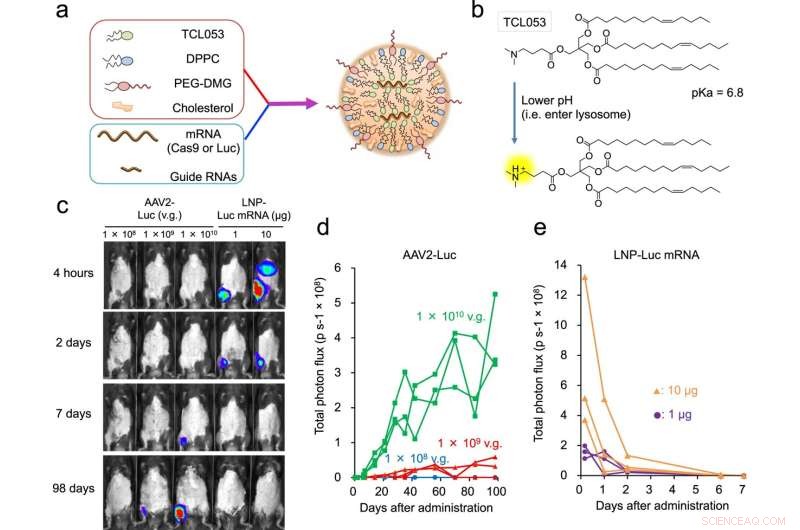
Fig. 1:LNP-medieret Luc-mRNA eller CRISPR-Cas9 mRNA/sgRNA levering til muskelvæv. en skematisk illustration af LNP-CRISPR. Enten Luc mRNA eller Cas9 mRNA/sgRNA er indkapslet i LNP, der består af TCL053, DPPC (Dipalmitoylfhosphatidylcholin), PEG-DMG (Polyethylenglycol-dimyristoylglycerol) og kolesterol. b Kemisk struktur af det nyligt syntetiserede ioniserbare lipid, TCL053. c Repræsentative bioluminescensbilleder af C57BL/6J-mus efter den intramuskulære injektion af AAV2-Luc (1 × 108, 1 × 109 eller 1 × 1010 v.g., vektorgenomer) eller LNP-μ1 mRNA (1 mRNA (1 mRNA). d, e Kvantificering af bioluminescenssignalet i skeletmuskulatur fra C57BL/6J-mus behandlet med AAV2-Luc (d) eller LNP-Luc mRNA (e). De samme mus (n = 3 mus pr. gruppe) blev undersøgt gentagne gange over tid. Samlede fluxdata (p s−1, fotoner pr. sekund) plottes som en enkelt linje pr. mus. Kredit:DOI:10.1038/s41467-021-26714-w
Mange vanskelige sygdomme er resultatet af en genetisk mutation. Genom-redigeringsteknologi lover at rette op på mutationen og dermed nye behandlinger til patienter. Det er dog stadig en stor udfordring at få teknologien til de celler, der har brug for korrektionen. En ny undersøgelse ledet af CiRA Junior Associate Professor Akitsu Hotta og i samarbejde med Takeda Pharmaceutical Company Limited som en del af T-CiRA Joint Research Program rapporterer, hvordan lipid nanopartikler giver et effektivt middel til levering til behandling af Duchenne muskeldystrofi (DMD) hos mus .
Sidste års Nobelpris i kemi til opdagerne af CRISPR-Cas9 cementerede virkningen af genomredigeringsteknologi. Mens CRISPR-Cas9 kan anvendes til landbrug og husdyr til mere nærende mad og robuste afgrøder, er den største opmærksomhed i medierne på dets medicinske potentiale. DMD er blot en af de mange sygdomme, som forskere forudser en behandling ved hjælp af CRISPR-Cas9.
"Oligonukleotid-lægemidler er nu tilgængelige for DMD, men deres virkninger er forbigående, så patienten skal gennemgå ugentlige behandlinger. På den anden side er CRISPR-Cas9-effekterne langvarige," sagde Hotta.
DMD resulterer i progressiv muskelatrofi i hele kroppen. Patienter begynder normalt at vise symptomer, såsom at falde let og manglende evne til at løbe før skolealderen, og de er ofte i respirator før voksenalderen.
For en sygdom som DMD er det nødvendigt at målrette en bred vifte af skeletmuskler, hvilket betyder, at flere injektioner er vigtige. Aktuelt undersøgte leveringssystemer anvender ikke-patogene vira til at levere CRISPR-Cas9, men disse vira inducerer immunreaktioner og produktion af antistoffer, som forbyder flere injektioner.
Lipid nanopartikler kan forhindre disse reaktioner. Som deres navn antyder, er lipid-nanopartikler små partikler med en diameter på mindre end 0,1 µm og består af lipider, der ændrer deres egenskaber som reaktion på surhed. Denne funktion gør det muligt for dem at forblive intakte uden for cellen, men når de først er inde i dem, brister de for at frigive deres indhold, såsom CRISPR-Cas9, som derefter er fri til at korrigere genmutationen. Lipidnanopartikler bliver brugt til COVID-19-vacciner, men deres nytte til genomredigeringsterapi er stadig under undersøgelse. Som en del af T-CiRA Joint Research Program har Hotta udviklet lipidnanopartikler, der kan levere genomredigeringsteknologi til cellen.
Efter at have eksperimenteret med flere formuleringer rapporterer undersøgelsen om en ny lipid-nanopartikel, der indkapsler CRISPR-Cas9 inde i og målretter muskelceller i mus.
I modsætning til oligonukleotidlægemidler, hvis virkninger i mus konstant aftog efter behandling og forsvandt efter et par måneder, viser undersøgelsen, at levering af CRISPR-Cas9 med den nye lipid-nanopartikel opretholdt en konstant effekt i muskler, der varede mere end et år.
Ydermere var virkningerne tydelige, selv når partiklerne blev leveret med flere intramuskulære injektioner, hvorimod den virusbaserede levering ikke havde en effekt efter den anden injektion. Derudover havde intravenøst perfunderede lipid-nanopartikler i lemmerne terapeutisk fordel på flere muskelvæv.
Som tilføjelse til sikkerheden bemærkede Hotta, "CRISPR-Cas9 forsvandt fra kroppen inden for et par dage. Det betyder, at risikoen for genomredigering uden for målet er minimal, men de terapeutiske virkninger varer længe." + Udforsk yderligere
CRISPR/Cas9-genredigering øger effektiviteten af ultralydskræftbehandling
 Varme artikler
Varme artikler
-
 Betydelige fremskridt i stabilisering af perovskit-solcellerPerovskit-solceller med metaloxidhul og elektrontransportlag. Kredit:Tunde Akinloye/CNSI UCLA professor Yang Yang, medlem af California NanoSystems Institute, er en verdenskendt innovatør af solce
Betydelige fremskridt i stabilisering af perovskit-solcellerPerovskit-solceller med metaloxidhul og elektrontransportlag. Kredit:Tunde Akinloye/CNSI UCLA professor Yang Yang, medlem af California NanoSystems Institute, er en verdenskendt innovatør af solce -
 Karakterisering af magnetiske nanovortices forenkletIllustration af en Skyrmion. Kredit:Nature Communications Magnetiske nanovortices, såkaldte skyrmions, tælle blandt de mest lovende kandidater til fremtidens informationsteknologi. Processorer og
Karakterisering af magnetiske nanovortices forenkletIllustration af en Skyrmion. Kredit:Nature Communications Magnetiske nanovortices, såkaldte skyrmions, tælle blandt de mest lovende kandidater til fremtidens informationsteknologi. Processorer og -
 Følsom og selektiv påvisning af carbon nanorør via fotoluminescensVed hjælp af fotoluminescerende sonder, forskere har udtænkt en følsom og selektiv måde at detektere kulstof nanorør på. Innovationer inden for energi og elektronik, sammen med traditionelle armerings
Følsom og selektiv påvisning af carbon nanorør via fotoluminescensVed hjælp af fotoluminescerende sonder, forskere har udtænkt en følsom og selektiv måde at detektere kulstof nanorør på. Innovationer inden for energi og elektronik, sammen med traditionelle armerings -
 Ny teknik farver biomolekyler i vævKredit:TU Delft En ekstra detektor på et elektronmikroskop kan hjælpe med at bestemme, hvilke molekyler der findes i hvilke dele af en celle. Dette rapporterer forskere ved UMCG og Delft Universit
Ny teknik farver biomolekyler i vævKredit:TU Delft En ekstra detektor på et elektronmikroskop kan hjælpe med at bestemme, hvilke molekyler der findes i hvilke dele af en celle. Dette rapporterer forskere ved UMCG og Delft Universit
- Metallisk skum kan opsuge lyd under højt tryk, miljøer med høje temperaturer såsom jetmotorer
- Motor med en diameter på fem millimeter drives direkte med lys
- Projekter til messesalg af solsystemet til anden klasse
- Sådan løser du grundlæggende sandsynlighedsproblemer, der involverer en mønt Flip
- Hvad er pH for destilleret vand?
- Ny kvasipartikel opdaget:Introduktion af Pi-ton


