Intracellulære temperatursensorer:Proteinkompleks udviser temperaturfølsom aktivitet
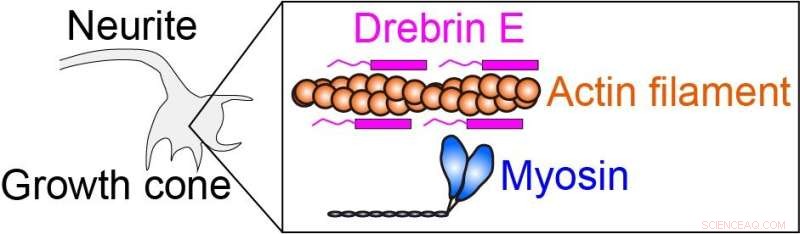
Intracellulær kraft frembringes af myosin, der interagerer med actinfilament (proteinfilament). Drebrin E kan hæmme actin-myosin-interaktionen og dermed regulere den intracellulære kraft. Det har været kendt, at koncentrationen af drebrin E falder under dyrenes udvikling. En sammenhæng mellem drebrinkoncentrationen og actin-myosin-aktiviteten er imidlertid forblevet uklar, især ved den fysiologiske temperatur. Kredit:Hiroaki Kubota et al.
En grad celsius kan gøre en forskel:Et team af efterforskere ledet af Osaka University har demonstreret regulering af et kritisk proteinkompleks, der kun forekommer ved fysiologisk temperatur.
For at studere proteiners funktioner undersøger efterforskere rensede proteiner in vitro. Sådanne eksperimenter er generelt begrænset til temperaturer under fysiologisk temperatur for at forhindre termisk skade på proteinerne. Holdet har overvundet dette problem ved at anvende optisk styret opvarmning med en pulserende infrarød laser. "Med denne metode kan proteiner opvarmes op til 40 grader Celsius uden skader på proteinerne," siger hovedforfatter Hiroaki Kubota, "hvilket gør os i stand til at undersøge, hvordan proteiner virker ved deres fysiologiske temperatur."
Forskerne anvendte denne opvarmningsmetode til at studere actomyosinkomplekset. Actomyosin kraftgenerering, som er resultatet af interaktionen mellem myosin molekylære motorer og actin filamenter, er en afgørende proces, der styrer cellemotilitet og morfologi. Proteinet drebrin E har vist sig at hæmme disse interaktioner, men dets reguleringsmekanisme er uklar. For at afklare drebrin E's rolle anvendte holdet mikroskopisk opvarmning til actomyosin i nærvær af drebrin og observerede den motilitet, der frembringes af actomyosin kraftgenerering over et område fra stuetemperatur til fysiologisk temperatur.
Forskerne fandt ud af, at hæmningen af actomyosin-motiliteten af drebrin E elimineres øjeblikkeligt og reversibelt under opvarmning, afhængigt af drebrin E-koncentrationen. Når temperaturen stiger, falder inhiberingen af actomyosin-motiliteten af drebrin E. Holdet fandt også, at den reducerede hæmning ikke udelukkende er forårsaget af dissociation af drebrin E fra actin. I stedet regulerer bundet drebrin E i samarbejde actomyosinaktivitet, sandsynligvis ved at ændre actinstrukturen.
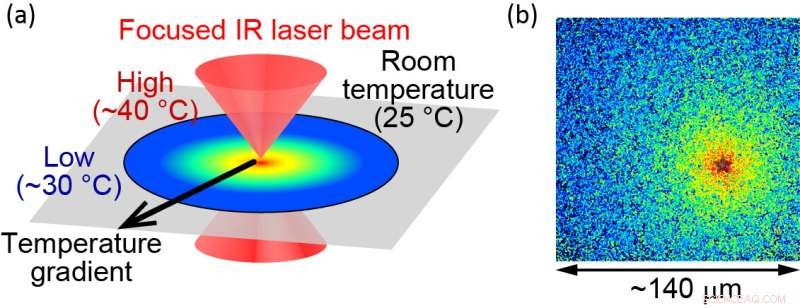
(a) Illustration af den optisk kontrollerede mikroskopiske opvarmningsmetode. (b) Lokaliseret temperatur visualiseres ved hjælp af fluorescerende molekyler. Varmekilden er placeret ved "stjernen", hvor temperaturen måles til cirka 40 °C. Enden af synsfeltet er cirka 30 °C. Størrelsen af synsfeltet er omkring 140 μm. Kredit:Hiroaki Kubota et al.
Interessant nok viser actomyosin-motiliteten under fysiologisk temperatur et gradvist fald med stigende drebrin E-koncentration. Alligevel ændres adfærden ved 36,5 grader Celsius til 37,5 grader Celsius, og drebrin E udviser en hæmningsadfærd af switch-type. Motiliteten er upåvirket af drebrin E-koncentrationen, indtil en tærskel er nået, hvilket umiddelbart resulterer i hæmning. Deres resultater tyder på, at tærskelkoncentrationen svarer til tidligere rapporterede fysiologiske drebrin E-koncentrationer.
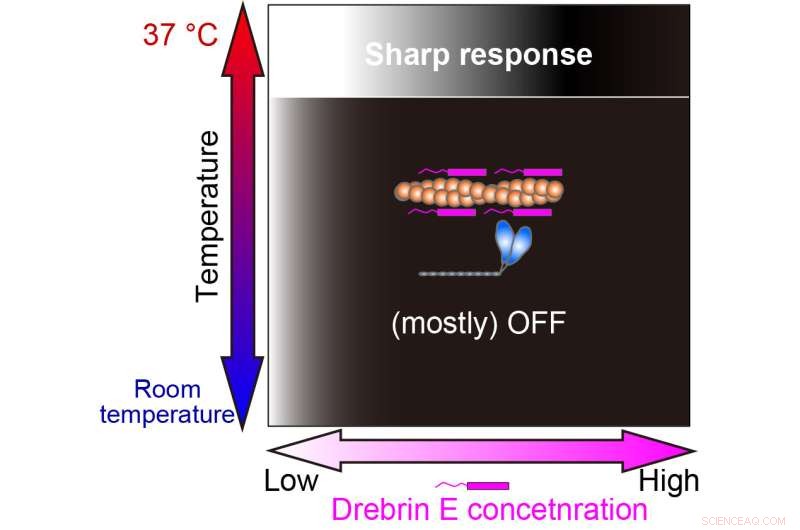
Vores undersøgelse afslørede, at reguleringen af actin-myosin-interaktion med drebrin E kun er effektiv ved den fysiologiske temperatur (37 °C). Den hvid-sort gradation repræsenterer kraftproduktionen Til (hvid) og Fra (sort). Kredit:Hiroaki Kubota et al.
Denne temperaturafhængige regulering af drebrin E er bemærkelsesværdig og har mange implikationer for fremtidige undersøgelser. "Disse resultater tyder på vigtigheden af, at gravide pattedyr opretholder den passende kropstemperatur for at sikre præcis udvikling af et embryo," siger Madoka Suzuki, seniorforfatter. Ydermere, ved at opnå en præcis forståelse af mekanismerne i cellulært temperaturfølende maskineri, vil vi muligvis være i stand til at innovere udviklingen af kunstige nanoskala temperatursensorer.
Artiklen "Microscopic temperature control reveals cooperative regulation of actin-myosin interaction by drebrin E" blev offentliggjort i Nano Letters . + Udforsk yderligere
Kontrolleret ardannelse i hjernen
 Varme artikler
Varme artikler
-
 Ny metode kan skinne et helbredende lys på hjernen for dem med bevægelsesforstyrrelserKunstnerens gengivelse viser røntgenstråler, der rammer radioluminescerende nanopartikler i hjernen, som udsender rødt lys, der udløser en natrium (Na+) og kalium (K+) iontilstrømning og derved aktive
Ny metode kan skinne et helbredende lys på hjernen for dem med bevægelsesforstyrrelserKunstnerens gengivelse viser røntgenstråler, der rammer radioluminescerende nanopartikler i hjernen, som udsender rødt lys, der udløser en natrium (Na+) og kalium (K+) iontilstrømning og derved aktive -
 Tatoveringer markerer stedet - til operation - og forsvinder derefterForskere lavede et blæk til markering af kirurgimål på huden ved at kombinere en polymer (til venstre) med fluorescens supramolekylære nanopartikler (til højre). Kredit:Jin-sil Choi/ Hsian-Rong Tseng
Tatoveringer markerer stedet - til operation - og forsvinder derefterForskere lavede et blæk til markering af kirurgimål på huden ved at kombinere en polymer (til venstre) med fluorescens supramolekylære nanopartikler (til højre). Kredit:Jin-sil Choi/ Hsian-Rong Tseng -
 Fleksibel, Bærbar røntgendetektor kræver ikke tungmetallerEn fleksibel halvledende metal-organisk ramme blev indbygget i en prototype, bærbar røntgendetektor til strålingsovervågning og billeddannelse. Kredit:Tilpasset fra Nano Letters 2021, DOI:10.1021/acs.
Fleksibel, Bærbar røntgendetektor kræver ikke tungmetallerEn fleksibel halvledende metal-organisk ramme blev indbygget i en prototype, bærbar røntgendetektor til strålingsovervågning og billeddannelse. Kredit:Tilpasset fra Nano Letters 2021, DOI:10.1021/acs. -
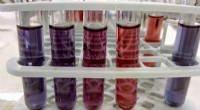 Hvorfor nanoteknologi er mere end bare et modeordFarven på guld nanopartikler i suspension varierer alt efter størrelsen af nanopartiklerne. Kredit:Valeg96, CC BY Hvad formoder ordet nanoteknologi for dig? Jeg har brugt den bedste del af en u
Hvorfor nanoteknologi er mere end bare et modeordFarven på guld nanopartikler i suspension varierer alt efter størrelsen af nanopartiklerne. Kredit:Valeg96, CC BY Hvad formoder ordet nanoteknologi for dig? Jeg har brugt den bedste del af en u
- Sådan fungerede Totable Tornado Observatory
- De talende døde:Begravelser kaster nyt lys over de tidligste mennesker i Indonesien
- Partikler er farligere end hidtil antaget
- Hvordan man laver cytoplasma til en celleprojekt
- Ser inde i super tåge
- Astronomer forudsiger bombardement fra asteroider og kometer i andre planetsystemer


