Skal mRNA være indkapslet i en lipidbelægning for at fungere som en vaccine?
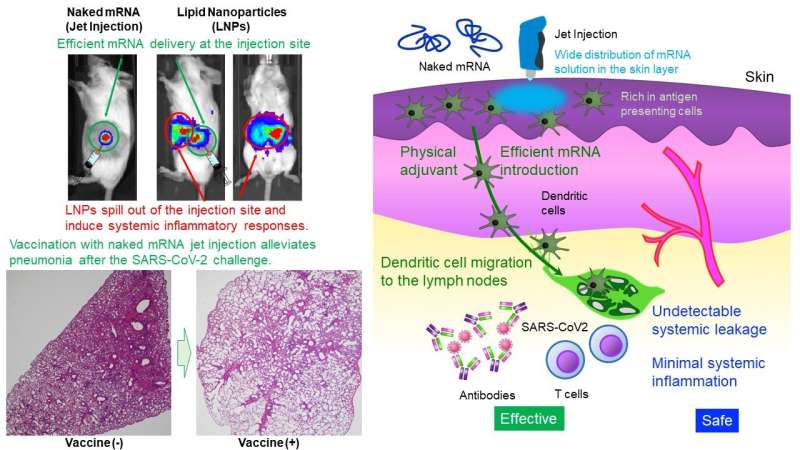
Uchida Laboratory of Innovation Center of NanoMedicine har vist, at intradermal administration af mRNA alene (nøgen mRNA) uden beskyttelse af nanopartikler inducerede robust vaccination mod SARS CoV-2, en virus, der forårsager COVID-19, hos mus og primater. mRNA er meget ustabilt og anses generelt for at kræve en lille kapsel, såsom lipid-nanopartikler (LNP'er), til administration.
Metoden rapporteret her er den første nøgne mRNA-vaccine, der demonstrerer forebyggelse mod SARS-CoV-2. Uden at bruge LNP'er, som med stor sandsynlighed forårsager systemiske bivirkninger, kan denne vaccine tillade gentagen dosering. Det er nu under udvikling til kliniske forsøg. Detaljerede forskningsresultater vil blive offentliggjort i Molecular Therapy .
Under COVID-19-pandemien har mRNA-vacciner vist enestående effektivitet med milliarder af doser administreret over hele verden. Imidlertid er der opstået udfordringer midt i deres hurtige udvikling, især vedrørende relativt stærke bivirkninger, herunder alvorlige, som fortsat er væsentlige problemer.
Selvom disse bivirkninger kan anses for acceptable for et begrænset antal doser under en pandemi, er en sikrere platform, der tillader flere doser over en levetid, ønskelig for igangværende COVID-19-boostere og udvidelsen af mRNA-vaccineapplikation til andre infektionssygdomme. Nuværende mRNA-vacciner er blevet forbundet med bivirkninger, primært tilskrevet lipidnanopartikler (LNP'er), der bærer mRNA'et (mRNA dækket af en lipidbelægning).
LNP'er har immunstimulerende egenskaber og kan løbe ud af injektionsstedet, hvilket fører til systemiske inflammatoriske reaktioner. Ikke desto mindre spiller LNP'er afgørende roller i vaccinens effektivitet, såsom [Funktion I] forhindrer mRNA-nedbrydning og effektiv levering af mRNA til celler, [Funktion II] migrerer til lymfeknuder for at levere mRNA til immunceller og [Funktion III] stimulerer immunsystemet gennem immunstimulerende lipider. Denne undersøgelse sigter mod at opnå disse funktioner uden at stole på LNP'er.
Denne undersøgelse giver et ligetil og sikkert design, administration af nøgent mRNA. Med hensyn til [Funktion II] findes få immunceller i muskelvæv, et nuværende administrationssted for mRNA-vacciner. Derfor blev hudvævet, som er mere rigeligt i immunceller, målrettet.
Desuden brugte forskerholdet til [Funktion I] en Jet Injector, der letter mRNA-levering til hudcellerne ved at udnytte fysisk stress induceret af jetflow. I en reporterundersøgelse forbedrede Jet Injector mRNA-leveringseffektiviteten med mere end 100 gange sammenlignet med en konventionel kanyle- og sprøjteinjektion. Desuden forblev mRNA på injektionsstedet uden påviselig systemisk lækage.

På den anden side migrerede mRNA-belastede LNP'er (mRNA tilsløret i en lipidkappe) til leveren, milten og andre systemiske organer efter intradermal administration, hvilket fremkaldte inflammationer der. Derudover var inflammation på injektionsstedet meget lille i vores metode, hvorimod mRNA indhyllet i en lipidbelægning inducerede infiltration af inflammatoriske celler og vævsnekrose.
Dernæst demonstrerede forskerholdet først vaccinationsevnen af nøgent mRNA ved hjælp af et modelantigen. Jet-injektoren forbedrede drastisk effektiviteten af antistofproduktion til et niveau, der kan sammenlignes med det for mRNA indhyllet i en lipidbelægning ved de maksimalt tolerable doser.
Disse antistoffer bekæmper vira i kroppen og forhindrer infektion, men de kan ikke fjerne inficerede celler. På den anden side fjerner cellulær immunitet sådanne syge celler og spiller en afgørende rolle i forebyggelsen af alvorlige sygdomme. Spændende nok øger den nøgne mRNA-vaccine effektivt antallet af immunocytter, såsom CD4-positive T-celler og CD8-positive T-celler.
Derefter udførte forskerholdet virusudfordringseksperimenter efter den nøgne mRNA-vaccination rettet mod spidsproteinet fra SARS-CoV-2-viruset. Vaccinationen sænkede signifikant mængden af virus i lungerne og lindrede lungebetændelse sammenlignet med en uvaccineret kontrol. Denne vaccine gav cynomolgus-aber en vaccineeffektivitet, der kunne sammenlignes med musens effekt uden væsentlige bivirkninger.
Nærværende undersøgelse omfatter også mekanistiske analyser. Med hensyn til [Funktion II] forblev den nøgne mRNA-vaccine på injektionsstedet og migrerede ikke til lymfeknuderne. På den anden side migrerede antigen-præsenterende celler, der optog mRNA på injektionsstedet, til lymfeknuderne, hvilket kan bidrage til vaccinationseffektiviteten.
Faktisk inducerede vaccinen modningen af lymfeknuden nær injektionsstedet. For [Funktion III] forårsagede Jet Injector forbigående inflammation lokaliseret til injektionsstedet og rekrutterede lymfocytter. Kanyle- og sprøjteinjektion af nøgent mRNA inducerede ikke et sådant inflammatorisk respons. Disse resultater tyder på, at immunstimuleringen af Jet Injector kan fungere som en fysisk adjuvans for at øge vaccinationseffektiviteten. Observerede lokale inflammatoriske reaktioner forsvandt i løbet af få dage.
Som konklusion reducerer den nøgne mRNA-vaccine systemiske bivirkninger, et problem med mRNA indkapslet i en lipidkappe, og inducerer immunitet, der er tilstrækkelig til beskyttelse mod infektionssygdomme. Dette er en verdensførende præstation inden for forebyggelse af infektionssygdomme med mRNA alene. I praksis kan denne vaccine blive en platform, der tillader gentagen dosering med mindre bivirkninger. I øjeblikket udføres yderligere undersøgelser med det formål at et klinisk forsøg er planlagt til 2026.
Flere oplysninger: Saed Abbasi et al., Bærerfri mRNA-vaccine inducerer robust immunitet mod SARS CoV-2 hos mus og ikke-menneskelige primater uden systemisk reaktogenicitet, Molecular Therapy (2024). DOI:10.1016/j.ymthe.2024.03.022
Journaloplysninger: Molekylær terapi
Leveret af Innovation Center of NanoMedicine
 Varme artikler
Varme artikler
-
 Nanometer grafen gør en ny OLED-skærmBilledkredit:Junbo Wu/Stanford University Forskere ved Stanford University har med succes udviklet et helt nyt koncept af organiske lysdioder (OLEDer) med nogle få nanometer grafen som transparent
Nanometer grafen gør en ny OLED-skærmBilledkredit:Junbo Wu/Stanford University Forskere ved Stanford University har med succes udviklet et helt nyt koncept af organiske lysdioder (OLEDer) med nogle få nanometer grafen som transparent -
 Flådens forskere rekrutterer selvlysende nanopartikler til at afbilde hjernens funktionRekruttering af selvlysende nanopartikler til at afbilde hjernefunktion, forskere ved US Naval Research Laboratory (NRL) er i gang med at udvikle den næste generation af funktionelle materialer, der k
Flådens forskere rekrutterer selvlysende nanopartikler til at afbilde hjernens funktionRekruttering af selvlysende nanopartikler til at afbilde hjernefunktion, forskere ved US Naval Research Laboratory (NRL) er i gang med at udvikle den næste generation af funktionelle materialer, der k -
 Spray-on hukommelse kan muliggøre bøjelig digital lagringDuke University-forskere har udviklet en ny spray-on digital hukommelse (øverst til venstre), der kan bruges til at bygge programmerbare elektroniske enheder på fleksible materialer som papir, plast e
Spray-on hukommelse kan muliggøre bøjelig digital lagringDuke University-forskere har udviklet en ny spray-on digital hukommelse (øverst til venstre), der kan bruges til at bygge programmerbare elektroniske enheder på fleksible materialer som papir, plast e -
 Neuron og synapse-mimetiske spintronics-enheder udvikletNeuron og synapse i biologisk neuralt netværk. Kredit:Aleksandr Kurenkov og Shunsuke Fukami En forskergruppe fra Tohoku University har udviklet spintronics-enheder, som er lovende for fremtidige e
Neuron og synapse-mimetiske spintronics-enheder udvikletNeuron og synapse i biologisk neuralt netværk. Kredit:Aleksandr Kurenkov og Shunsuke Fukami En forskergruppe fra Tohoku University har udviklet spintronics-enheder, som er lovende for fremtidige e
- Tundra Karakteristik
- Tyndeste grafenark reagerer stærkt med hydrogenatomer; tykkere ark er relativt upåvirket
- 520 millioner år gammelt ormefossil løser mysteriet om, hvordan moderne insekter, edderkopper og k…
- NASA finder orkanen Norman hamret af vindskæring
- Vindmøller kan dække 40 procent af det nuværende elforbrug i Tyskland
- Hvilke af metalloiderne har den mindste atomradius?


