GPS nanopartikelplatform leverer præcist terapeutisk nyttelast til kræftceller
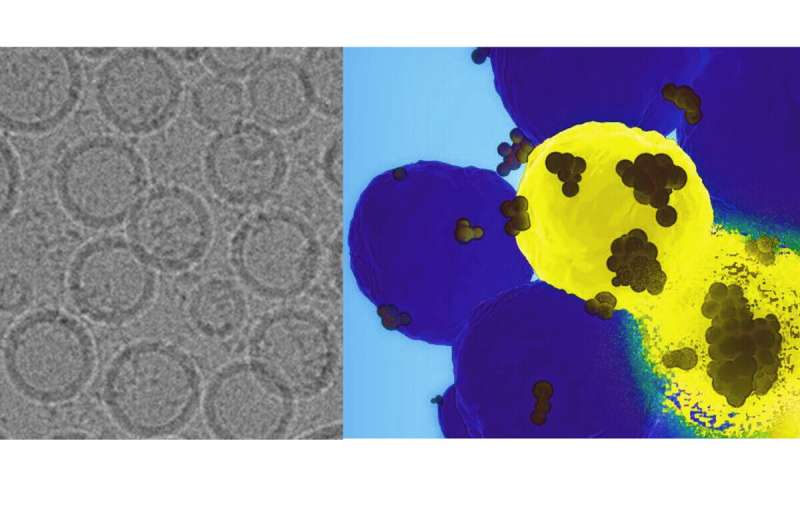
En nyudviklet "GPS-nanopartikel", der injiceres intravenøst, kan komme ind på kræftceller for at levere et genetisk slag til proteinet, der er involveret i tumorvækst og -spredning, ifølge forskere fra Penn State. De testede deres tilgang i menneskelige cellelinjer og i mus for effektivt at slå et kræftfremkaldende gen ned, og rapporterede, at teknikken potentielt kan tilbyde en mere præcis og effektiv behandling for notorisk svære at behandle basallignende brystkræft.
De udgav deres arbejde i ACS Nano . De indgav også en foreløbig ansøgning om patent på teknologien beskrevet i undersøgelsen.
"Vi udviklede en GPS-nanopartikel, der kan finde det sted, hvor det er nødvendigt," sagde den korresponderende forfatter Dipanjan Pan, Dorothy Foehr Huck &J. Lloyd Huck Chair Professor i nanomedicin og professor i nuklear teknik og i materialevidenskab og -teknik ved Penn State .
"Når den først er der - og kun der - kan den levere genredigeringsproteiner for at forhindre kræftcellerne i at sprede sig. Det var en vanskelig opgave, men vi viste, at systemet virker til basallignende brystkræft."
I lighed med triple-negative brystkræftformer kan basallignende brystkræft være mindre udbredt end andre brystkræftformer, men de kan være langt mere udfordrende at behandle, hovedsagelig fordi de mangler de tre terapeutiske mål, der findes i andre brystkræftformer. De har også tendens til at være aggressive, hurtigt voksende tumorer og udskille celler, der spredes andre steder i kroppen. Disse celler kan udså yderligere tumorer, en proces kaldet metastase.
"Metastase er en stor udfordring, især med kræftformer som triple-negative og basallignende brystkræft," sagde Pan. "Kræften kan være svær at opdage og dukker ikke op under en rutinemæssig mammografi, og den rammer primært den yngre eller afroamerikanske befolkning, som måske ikke modtager forebyggende behandling endnu. Resultatet kan være meget, meget dårligt, så der er en klar udækket klinisk behov for mere effektive behandlinger, når kræften ikke fanges tidligt nok."
Holdet fremstillede en nanopartikel af trojansk hest, forklædte den med specialdesignede fedtmolekyler, der ligner naturligt forekommende lipider og pakkede den fuld af CRISPR-Cas9-molekyler. Disse molekyler kan målrette mod det genetiske materiale i en celle, identificere et bestemt gen og slå det ned eller gøre det ineffektivt. I dette tilfælde målrettede systemet human forkhead box c1 (FOXC1), som er involveret i at anstifte metastaser.
Pan beskrev designerlipiderne som "zwitterioniske", hvilket betyder, at de har næsten neutral ladning på nanopartiklernes skal. Dette forhindrer kroppens immunsystem i at angribe nanopartiklerne – fordi den er forklædt som et ikke-truende, normalt molekyle – og kan hjælpe med at frigive nyttelasten, men kun når lipiderne genkender kræftcellens lave pH-miljø.
For at sikre, at lipiderne kun aktiveres ved den lave pH, designede forskerne dem til at flytte deres ladninger til positive, når de kommer ind i det mere sure tumormikromiljø, hvilket udløser frigivelsen af nyttelast.
Men kroppen er et stort sted, så hvordan kunne forskerne sikre, at CRISPR-Cas9-nyttelasten nåede det rigtige mål? For at sikre, at nanopartiklerne ville binde sig til de rigtige celler, vedhæftede de et epitelcelleadhæsionsmolekyle (EpCAM), som er kendt for at binde sig til basallignende brystkræftceller.
"Ingen har nogensinde forsøgt at målrette mod en basal-lignende bryst-lignende cancercelle med kontekst-responsivt leveringssystem, der genetisk kan slå genet af interesse," sagde Pan. "Vi er de første til at vise, at det kan lade sig gøre."
Andre har udviklet virale leveringssystemer, kapring af en viruspartikel for at bære behandling til cellerne, og ikke-virale leveringssystemer ved hjælp af nanopartikler. Forskellen, sagde Pan, for hans teams tilgang er overfladelipidet designet til kun at reagere i målmiljøet, hvilket reducerer potentialet for levering uden for målet og skade på raske celler.
Desuden tilføjede han, da kroppen ikke anser lipiderne for at være en trussel, er der mindre chance for et immunrespons, hvilket de validerede i deres eksperimenter.
Holdet testede først tilgangen i menneskelige triple-negative brystkræftceller og validerede, at nanopartiklerne ville implementere CRISPR/Cas9-systemet i det korrekte miljø. De bekræftede, at nanopartiklerne kunne finde vej til en tumor i en musemodel, implementere systemet og med succes slå FOXC1 ned.
Dernæst, sagde Pan, planlægger forskerne at fortsætte med at teste nanopartikelplatformen med det endelige mål at anvende den klinisk på mennesker.
"Vi undersøger også, hvordan vi ellers kan anvende platformsteknologien," sagde Pan. "Vi kan tilpasse molekylerne på overfladen, den nyttelast, den bærer, og bruge den til at fremme heling på andre områder. Der er et stort potentiale med denne platform."
Flere oplysninger: Parikshit Moitra et al, kontekst-responsiv nanopartikel afledt af syntetiske Zwitterioniske ioniserbare fosfolipider i målrettet CRISPR/Cas9-terapi for basallignende brystkræft, ACS Nano (2024). DOI:10.1021/acsnano.4c01400
Leveret af Pennsylvania State University
 Varme artikler
Varme artikler
-
 Biomimetiske nanosvampe absorberer toksiner frigivet af bakterielle infektioner og giftIngeniører ved University of California, San Diego har opfundet en nanosvamp, der sikkert kan fjerne en bred klasse af farlige toksiner fra blodbanen, inklusive toksiner produceret af MRSA, E coli ,
Biomimetiske nanosvampe absorberer toksiner frigivet af bakterielle infektioner og giftIngeniører ved University of California, San Diego har opfundet en nanosvamp, der sikkert kan fjerne en bred klasse af farlige toksiner fra blodbanen, inklusive toksiner produceret af MRSA, E coli , -
 Nanoskala øer prikker lysdrevet katalysatorNano-øer af ruthenium klæber til en nanopartikel af aluminium. Rice University videnskabsmænd og kolleger ved University of Cambridge kombinerede aluminium nanopartikler og mindre metalpartikler, da d
Nanoskala øer prikker lysdrevet katalysatorNano-øer af ruthenium klæber til en nanopartikel af aluminium. Rice University videnskabsmænd og kolleger ved University of Cambridge kombinerede aluminium nanopartikler og mindre metalpartikler, da d -
 Vandnanoegenskaber som en nøglefaktor for sanitetIndesluttet vand på grafenporerne i nanometerstørrelse. Kredit:F. Leoni et at. Levende organismer, vira og teknologiske enheder har vandlag mellem deres celler eller dele og kan dø eller stoppe med
Vandnanoegenskaber som en nøglefaktor for sanitetIndesluttet vand på grafenporerne i nanometerstørrelse. Kredit:F. Leoni et at. Levende organismer, vira og teknologiske enheder har vandlag mellem deres celler eller dele og kan dø eller stoppe med -
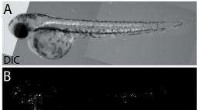 Forskere bruger plasmoniske nanobobler i levende organismer til at opdage, eliminere prostatakræftc…Et sæt billeder viser:A) et differentielt interferenskontrast (DIC) hvidt lysbillede af zebrafiskembryo mærket med fluorescerende humane prostatacancerceller; B) et fluorescerende billede af embryoet
Forskere bruger plasmoniske nanobobler i levende organismer til at opdage, eliminere prostatakræftc…Et sæt billeder viser:A) et differentielt interferenskontrast (DIC) hvidt lysbillede af zebrafiskembryo mærket med fluorescerende humane prostatacancerceller; B) et fluorescerende billede af embryoet
- Tesla omorganiserer for at fremskynde produktionen
- Regn bringer 2. Californiens superflor på 2 år
- Tørke-resistente plantegener kunne accelerere udviklingen af vandforbrugende effektive afgrøder
- Bikage af nanorør kan øge genteknikken
- Private virksomheder lancerer et nyt rumkapløb – her er hvad de kan forvente
- Udvikling af et nøgleelement til skalerbare kvantecomputere


