Opdagelse af den molekylære genkendelse af teknologiske faste stoffer ved mutante selvsamlende peptider
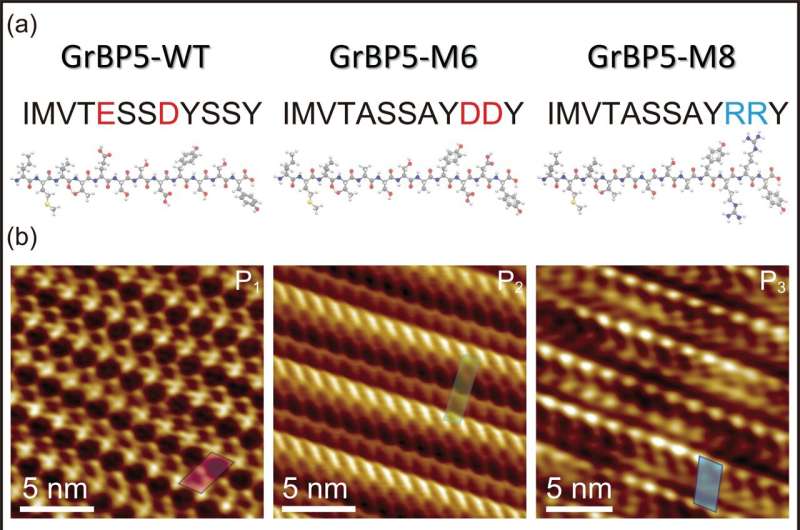
I en undersøgelse for nylig offentliggjort i tidsskriftet Small , brugte forskere fra Nano Life Science Institute (WPI NanoLSI), Kanazawa University, Japan, i samarbejde med professor Sarikaya, Seattle, USA, frekvensmoduleret atomkraftmikroskopi til at afsløre den molekylære arkitektur af genetisk designede og punktmuterede peptider og deres selvorganisationer hver især danner enkeltmolekyle tykke, distinkte biologiske krystaller på atomisk flad grafit og MoS2 overflader, der tilbyder en potentiel platform for hybridteknologier såsom bioelektronik, biosensorer og proteinarrays.
Proteiner er de vigtigste molekylære byggesten i biologi, der udfører enzymatiske funktioner, transporterer ioner og elektroner og udgør den vigtigste infrastruktur for cellulære arkitekturer, såsom ionpumper. Funktionerne af proteiner afhænger af deres aminosyresekvenser, som igen dikterer deres tredimensionelle molekylære strukturer.
Proteinernes aminosyresekvenser kodes af generne (DNA-kode) fra en given specialiseret celle. Enhver defekt i aminosyresekvensen, såsom en punktmutation, en ændring i placeringen af en aminosyre, en manglende aminosyre eller transposition af to eller flere aminosyrer, forventes derfor at påvirke proteinets molekylære struktur , hvilket afspejles i deres funktion, som ofte fører til genetiske sygdomme.
I lighed med proteiner er peptider også sammensat af aminosyreenheder, og hvert peptid har en unik sekvens; dog er de meget kortere, der spænder fra 10 til 30 enheder, og på samme måde kodet af DNA. De er nemmere at manipulere, designe og bruge sammenlignet med proteiner, som er meget større (hundrede eller tusinder af aminosyrer lange), svære at syntetisere og upraktiske at bruge.
Derfor er det bydende nødvendigt, at hvis fremtidens praktiske teknologi skal udvikles baseret på erfaringer fra biologi på molekylær skala, skal den grundlæggende videnskab etableres ved hjælp af peptider, som derefter kan implementeres i virkelige applikationer, såsom biosensorer , bioelektronik og logiske enheder, såvel som lægemidler, alt sammen baseret på lektioner fra biologi.
Ved at realisere denne præmis indledte professor Sarikaya en ny konvergensvidenskabelig tilgang for to årtier siden, der involverede genteknologi, molekylærbiologi, informatik, maskinlæring og materialevidenskab og -teknik i design af faste bindende peptider og demonstrerede deres anvendelse i praktiske hybridteknologier.
I denne nye undersøgelse muteres et af disse peptider, specifikt designet som et grafitbindende peptid, til to forskellige peptider, M6 og M8, hver nominelt den samme molekylvægt og størrelse, men indeholder punktmutationer af de ladede aminosyrer, en negativ og den anden positive henholdsvis.
Som forudsagt ville de fungere anderledes, hvilket de gjorde. Spørgsmålet, der imidlertid var umuligt at forudsige på forhånd, var, hvordan de præcist ville agere forskelligt fra hinanden og vildtype-(det originale) peptid, og hvad ville være detaljerne i deres molekylære struktur og deres kinetiske adfærd på overfladen af peptidet. substratgrafit.
Svarene på disse spørgsmål, hvis mangel hidtil begrænsede forståelsen af forholdet mellem mutanter og deres forudsigelige adfærd, krævede meget høj opløsning og direkte billeddannelse af molekylerne i deres oprindelige tilstande i vand over en periode på sekunder til timer.
Det er her, professor Takeshi Fukumas laboratorium kommer ind i billedet på WPI Nano Life Science Institute, Kanazawa University, hvor hans team har udviklet Frequency-Modulated Atomic Force Microscopy faciliteter, der er i stand til at udspørge objekter i molekylær skala ved nær-angstrøm billedopløsning og for lange perioder i vandige miljøer - en usædvanlig kombination af muligheder for et eksperimentelt system, især til biologisk forskning.
Med forskernes yderst dygtige eksperimentelle evner (med uudtømmelig tålmodighed i langvarige test), ledet af Dr. Ayhan Yurtsever, Dr. Kaito Hirata, Dr. Linhao Sun og Dr. Takeshi Fukuma, opdagede holdet adfærden hos mutanter i hidtil usete detaljer, der giver resultater med betydning, der krydser flere traditionelt forskellige discipliner, fra materialevidenskab til fysik, til kemi og biologi.
For det første, på trods af mutationerne og individuelt med en anden overordnet ladning, bandt hvert peptid ikke kun til grafitoverfladen, men blev også samlet og dannede enkeltmolekyletykke peptidkrystaller. Men mens den første mutant, den negativt ladede, dannede et krystallinsk skrå gitter med to molekyler (viklet om hinanden) i hvert gitter, dannede den anden mutant, den positivt ladede, et andet skråt gitter indeholdende et enkelt peptid.
Hvad der virkelig er værdifuldt her er, at peptidernes opførsel er simpelt og direkte relateret til deres molekylære arkitektur, modelleret ved hjælp af molekylær dynamik. Forskerne var derfor i stand til matematisk at beskrive forholdet mellem hvert af peptiderne (der hver danner et forskelligt skrå molekylært gitter) og det sekskantede gitter af grafitsubstratet, som udelukkende beskrives som chiral genkendelse.
I realiteten betyder dette, at hvert peptid er demonstreret at danne en hybrid grænseflade med substratgrafitten, bedst beskrevet som værende krystallografisk sammenhængende uden nogen mærkbar kløft imellem, ikke ulig ligand-receptor eller protein/DNA-interaktioner i biologi.
Hverken den molekylære genkendelse af faststofobjekter af et "levende" molekyle er blevet så tydeligt observeret før, og dets detaljer er heller ikke blevet beskrevet som chirale, hvilket begge bidrager til betydningen af resultaterne præsenteret i denne publikation.
På den ene side er der fra det biologiske perspektiv nu rigeligt med data og detaljer om, hvordan mutationer fører til molekylære konformationsændringer og den resulterende funktion af peptiderne, som kan udvides til proteiners adfærd, med betydning i genetiske mutationer og effektiv lægemiddeldesign.
Og på den anden side tyder sammenhængende hybridisering på, at animerede og livløse objekter i nanoskala er stabilt til stede ved den samme bløde grænseflade, der danner en eksklusiv molekylær bro, der bedst kunne beskrives ved sømløst at integrere biologi med solid-state-enheder.
Hvis det er tilfældet, forventes det, baseret på denne undersøgelse, at forskere og teknologer vil udvide repertoiret af det molekylære grundlag for fremtidige bio/nano-enheder enormt ved at bruge det simple molekylærbiologiske mutationsværktøj.
Flere oplysninger: Ayhan Yurtsever et al., Dynamics of Molecular Self-Assembly of Short Peptides at Liquid-Solid Interfaces – Effect of Charged Amino Acid Point Mutations, Small (2024). DOI:10.1002/sml.202400653
Journaloplysninger: Lille
Leveret af Kanazawa University
 Varme artikler
Varme artikler
-
 Ny metode til masseproduktion af grafen udvikletEt transmissionselektronmikroskopbillede af nanomaterialet grafen lavet med en ny teknik fra forskere ved Rensselaer. Den nye, stuetemperaturmetode kræver kun lidt forarbejdning og baner vejen for omk
Ny metode til masseproduktion af grafen udvikletEt transmissionselektronmikroskopbillede af nanomaterialet grafen lavet med en ny teknik fra forskere ved Rensselaer. Den nye, stuetemperaturmetode kræver kun lidt forarbejdning og baner vejen for omk -
 Varmebaseret teknik tilbyder en ny måde at måle mikroskopiske partikler påForskere har udviklet en ny varmebaseret teknik til at tælle og måle størrelsen af mikroskopiske partikler. Teknikken er billigere end lysbaserede teknikker og kan bruges på en bredere vifte af mate
Varmebaseret teknik tilbyder en ny måde at måle mikroskopiske partikler påForskere har udviklet en ny varmebaseret teknik til at tælle og måle størrelsen af mikroskopiske partikler. Teknikken er billigere end lysbaserede teknikker og kan bruges på en bredere vifte af mate -
 Ny metode udviklet til at forbedre holdbarheden af nano-elektroniske komponenter, yderligere halvl…Kredit:CC0 Public Domain Forskere fra University of South Florida udviklede for nylig en ny tilgang til at afbøde elektromigration i elektroniske forbindelser på nanoskala, der er allestedsnærvære
Ny metode udviklet til at forbedre holdbarheden af nano-elektroniske komponenter, yderligere halvl…Kredit:CC0 Public Domain Forskere fra University of South Florida udviklede for nylig en ny tilgang til at afbøde elektromigration i elektroniske forbindelser på nanoskala, der er allestedsnærvære -
 Hvordan gas-nanobobler accelererer faststof-væske-gas-reaktionerSkematisk belysning af en fast-væske-gas-reaktion etableret i en væskecelle.Naturmaterialer (2022). DOI:10.1038/s41563-022-01261-x Fast-væske-gas-reaktioner er almindelige i forskellige naturfænome
Hvordan gas-nanobobler accelererer faststof-væske-gas-reaktionerSkematisk belysning af en fast-væske-gas-reaktion etableret i en væskecelle.Naturmaterialer (2022). DOI:10.1038/s41563-022-01261-x Fast-væske-gas-reaktioner er almindelige i forskellige naturfænome
- Forstå sammenhængen mellem fracking og jordskælv
- Fysikere opdager nye regler for orbitaldannelse i kemiske reaktioner
- Forskere skaber nanofiber-gusher
- Hvordan fungerer en hydraulisk cylinderpumpe?
- Forskere bruger kunstige neurale netværk til præcist at forudsige kortsigtet solindstråling
- Miljøvidenskab Aktiviteter for børn


