En ny mikrometertyk porøs belægning med uovertrufne biomarkørdetektionsevner
Aldrende befolkninger og tendensen til at føre en mere stillesiddende livsstil i mange dele af verden menes at dramatisk øge antallet af mennesker, der lever med flere kroniske lidelser. Desuden bliver klimaændringer, såvel som skiftende mønstre i arealanvendelse og rejser, ved med at øge risikoen for infektionssygdomme, der kan dukke op og spredes lokalt og globalt.
At være i stand til at diagnosticere tilstedeværelsen og forløbet af alle disse sygdomme udgør hurtigt en voksende udfordring for sundhedssystemerne – en udfordring, der kun kan imødekommes ved hjælp af effektive point-of-care (POC) diagnostiske test ud over lægens kontor og avanceret medicinsk faciliteter.
POC-test gav folk adskillige fordele under COVID-19-pandemien, men denne tilgang skal anvendes meget bredere og gøre det muligt for læger og patienter at undersøge patologiske tilstande dybere. Nuværende POC-diagnostiske teknologier måler kun en enkelt sygdomsbiomarkør eller nogle gange flere biomarkører, der tilhører den samme klasse af molekyler, såsom forskellige RNA'er, proteiner eller antistoffer.
Men måling af flere biomarkører fra forskellige molekylære klasser kunne informere mere omfattende om den tilstand en sygdom er i, dens sværhedsgrad og progression over tid og endda tage højde for person-til-person forskelle i, hvordan den udvikler sig.
Elektrokemiske biosensorer, som omdanner et kemisk signal i form af en biomarkør i en lille prøve af biovæske, såsom blod, spyt eller urin, til et elektrisk signal, der i styrke svarer til den detekterede mængde af biomarkøren, kunne give svar på mange POC diagnostiske problemer.
I princippet kan flere sensorer for forskellige biomarkørmolekyler kombineres i multipleksede sensorarrays, og vigtigst af alt er kampen mod "biofouling", den tidligere uundgåelige ruin af elektrodeoverflader af uspecifikke biologiske molekyler indeholdt i prøver, blevet undgået ved konstruktion af tynde antifouling-belægninger var banebrydende på Wyss Institute ved Harvard University.
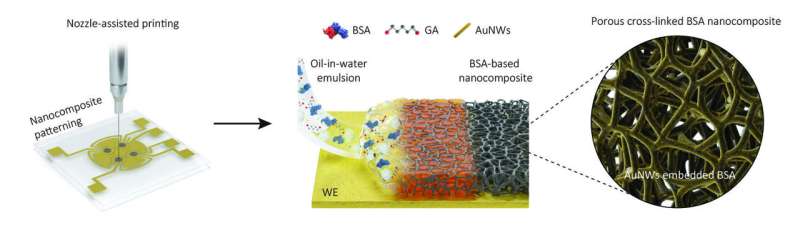
Nu har forskerholdet ved Wyss Institute sammen med flere samarbejdende institutter i Korea flyttet den elektrokemiske diagnostiske sansning et kritisk skridt videre mod dens bredere anvendelse ved at udvikle en ny nanokomposit porøs antifouling-belægning med en tykkelse på en mikrometer - diameteren på en bakterie - som er omkring 100 gange tykkere end tidligere belægninger.
Belægningens øgede tykkelse og et konstrueret porøst netværk inden i det muliggjorde inkorporering af meget højere antal biomarkør-detekterende prober i sensorer og dermed op til 17 gange højere følsomhed end tidligere best-in-class sensorer, samtidig med at de også gav overlegne antifouling-egenskaber .
I deres proof-of-concept-studie har forskerne bygget sensorer, der kombinerede evnen til at detektere COVID-19-specifikke nukleinsyre-, antigen- og værtsantistof-biomarkørmål i kliniske prøver med høj sensitivitet og specificitet. Deres resultater er offentliggjort i Nature Communications .
"Vores nye tykke porøse emulsionsbelægning adresserer direkte kritiske forhindringer, der i øjeblikket forhindrer den udbredte brug af elektrokemiske sensorer som centrale komponenter i omfattende POC-diagnostik for mange tilstande," sagde sidste forfatter og Wyss-grundlægger Donald Ingber, M.D., Ph.D. .
"Men går langt ud over det, kan det også åbne op for nye muligheder for at udvikle sikrere og mere funktionelle implanterbare enheder og andre sundhedsovervågningssystemer på flere sygdomsfronter. At overvinde biobegroning og følsomhedsproblemer er udfordringer, der påvirker mange af disse bestræbelser."
Ingber er også Judah Folkman-professor i vaskulær biologi ved Harvard Medical School og Boston Children's Hospital og Hansjörg Wyss-professor i bioinspireret ingeniørvidenskab ved Harvard John A. Paulson School of Engineering and Applied Sciences.
Tykkere belægning, bedre detektion
I 2019 udgav Wyss Institutes elektrokemiske sensorprojekt sit første skelsættende papir, der rapporterede om den første antifouling-belægning med hidtil usete biosensing-egenskaber.
I en række kritiske opfølgningsundersøgelser øgede holdet potentialet for elektrokemisk sensing ved yderligere at fremme belægningernes nanokemi for at gøre elektroder endnu mere følsomme over for biomarkører, tilføje vigtige multiplekseringsevner og udvikle omkostningsreducerende fremstillingsmetoder.
De mest avancerede biosensorer, som teamet konstruerede i Wyss' eRapid-platform, havde et funktionssæt, der allerede muliggør deres oversættelse til nogle kliniske indstillinger.
Belægningsmetoden, som teamet brugte, udsatte dog hele sensorchippen for nanokompositopløsningen og tillod kun at danne en relativt tynd belægning på omkring 10 nanometer på hele sensoroverfladen, hvilket begrænsede sensorernes funktionalitet på flere måder.
For eksempel begrænsede belægningens tynde diameter den maksimale mængde af sonde, der kunne indlæses i den, hvilket især bliver kritisk i større multipleksede sensorer, der stadig skal arbejde med små prøvevolumener og endnu mere i bestræbelserne på at miniaturisere multipleksede sensorer til deres brug i bærbare POC-diagnoseenheder.
"I denne nye undersøgelse kom vi med en helt ny løsning på dette problem, som resulterede i en 100 gange tykkere belægning. Vores nye tilgang udnytter en inkjet-printmetode, der giver os mulighed for at påføre denne tykke belægning meget lokalt på individuelle sensorer elementer," sagde tidligere Wyss Senior Scientist Pawan Jolly, Ph.D., som var medvirkende til at udvikle eRapid-platformen.
"Dette åbner op for nye muligheder:For det første kan vi inkludere meget større mængder af biomarkør-detekterende prober i belægningen, og i fremtiden kan sensorerne i komplekse arrays adresseres individuelt ved at anvende nanokompositkemi på dem, der er specifikt rettet mod specifikke biomarkørmodaliteter."
I stedet for bogstaveligt talt at dyppe elektrokemiske elektroder i en belægningsopløsning, som de gjorde for deres tidligere generation af sensorer, printede forskere et lag af en tæt olie-i-vand-emulsion gennem en fin dyse på elektroder. Efter fordampning af de bittesmå oliebobler forblev en 1 mikrometer tyk belægning på elektrodeoverfladen, der bestod af tværbundne polymere molekyler af blodproteinet albumin og indeholdt indbyrdes forbundne porer og elektronledende guld nanotråde.
"Det porøse netværk i denne nanokompositbelægning øger dramatisk den overflade, der kan bruges til at fastgøre specifikt konstruerede biomarkør-detekterende prober til, og som samtidig er tilgængelig for prøvevæsker. Som et resultat er detektionsfølsomheden betydeligt øget." forklarede førsteforfatter Jeong-Chan Lee, Ph.D., en postdoktor på Ingbers hold.
"Derudover giver dyseudskrivning os mulighed for at mønstre emulsionen udelukkende på den biomarkør-detekterende arbejdselektrode, mens den tilstødende referenceelektrode, der er indeholdt i hver sensor, holdes fri for den, hvilket reducerer uspecifik elektrisk støj og forbedrer specificiteten af vores målinger."
Fra COVID-19
Holdet genbrugte en tidligere udviklet kombination af detektionsreagenser til tre COVID-19-relaterede biomarkører for at mønstre et sensorelektrodearray ved hjælp af deres nyudviklede belægningsteknologi:en CRISPR-aktiveret sensor til et SARS-CoV-2 RNA, en sensorspecifik for et SARS-CoV-2-capsidantigen og en sensor for et virusstyret værtsantistof.
Testet med en samling patientprøver producerede den nye sensor 3,75 til 17 gange forbedret detektionsfølsomhed sammenlignet med en tidligere, der var fremstillet med de samme detektionssystemer og holdets bedste ikke-porøse, meget tyndere belægning. Den skelnede også positive fra negative prøver med 100 % nøjagtighed (specificitet).
"Elektrokemiske sensorer med denne næste generations belægning ville være ideelle til at overvåge virale udbrud, vaccinationsresponser og forstå sammenhænge mellem forskellige biomarkører i løbet af virusinfektioner, og i fremtiden kan de også bruges til andre sygdomme." sagde Lee.
Flere oplysninger: Jeong-Chan Lee et al., Mikrometertyk og porøs nanokompositbelægning til elektrokemiske sensorer med exceptionelle antifouling og elektroledende egenskaber, Nature Communications (2024). DOI:10.1038/s41467-024-44822-1
Journaloplysninger: Nature Communications
Leveret af Harvard University
 Varme artikler
Varme artikler
-
 Biomedicinsk hudlignende bandage er elastisk, holdbar og langtidsholdbarDe ledende nanotråde er omkring 50 nanometer i diameter og mere end 150 mikron lange, og er indlejret i et tyndt lag elastomer, eller elastisk polymer, omkring 1,5 mikron tyk. Kredit:Purdue University
Biomedicinsk hudlignende bandage er elastisk, holdbar og langtidsholdbarDe ledende nanotråde er omkring 50 nanometer i diameter og mere end 150 mikron lange, og er indlejret i et tyndt lag elastomer, eller elastisk polymer, omkring 1,5 mikron tyk. Kredit:Purdue University -
 Atomteknik med elektrisk bestrålingBeslutningstræ for atomteknik. pi→k står for sandsynligheden for en dynamisk proces fra en indledende konfiguration i til den endelige konfiguration k. Fysikerne antog, at elektronindfaldsvinklerne θe
Atomteknik med elektrisk bestrålingBeslutningstræ for atomteknik. pi→k står for sandsynligheden for en dynamisk proces fra en indledende konfiguration i til den endelige konfiguration k. Fysikerne antog, at elektronindfaldsvinklerne θe -
 Gas giver laser-induceret grafen super egenskaberLaser-induceret grafen skabt i nærvær af argongas er superhydrofob, hvilket betyder at den undgår vand. Processen udviklet på Rice University laver materialer, der kan være superhydrofile eller superh
Gas giver laser-induceret grafen super egenskaberLaser-induceret grafen skabt i nærvær af argongas er superhydrofob, hvilket betyder at den undgår vand. Processen udviklet på Rice University laver materialer, der kan være superhydrofile eller superh -
 Netop defekte nanodiamanter kunne producere næste generations værktøjer til billeddannelse og kom…Nærbillede af rensede diamanter på en laboratoriebænk. For lille til at se med det blotte øje, diamantoider er kun synlige, når de klumper sig fint sammen, sukkerlignende krystaller som disse. Sta
Netop defekte nanodiamanter kunne producere næste generations værktøjer til billeddannelse og kom…Nærbillede af rensede diamanter på en laboratoriebænk. For lille til at se med det blotte øje, diamantoider er kun synlige, når de klumper sig fint sammen, sukkerlignende krystaller som disse. Sta
- Forskel mellem væske og væske
- Kold tyrker! Minus 26 oven på Mount Washington til Thanksgiving
- Hvordan det største europæiske jorddatasæt blev født
- Ny metode til at bestemme, hvor modstandsdygtige floder er mod tørke
- At finde fordampet metal i luften på en exoplanet
- Teamet bruger diskret differentialgeometri til at karakterisere grafens form


