En ny måde at visualisere hjernekræft på nanoskala niveau
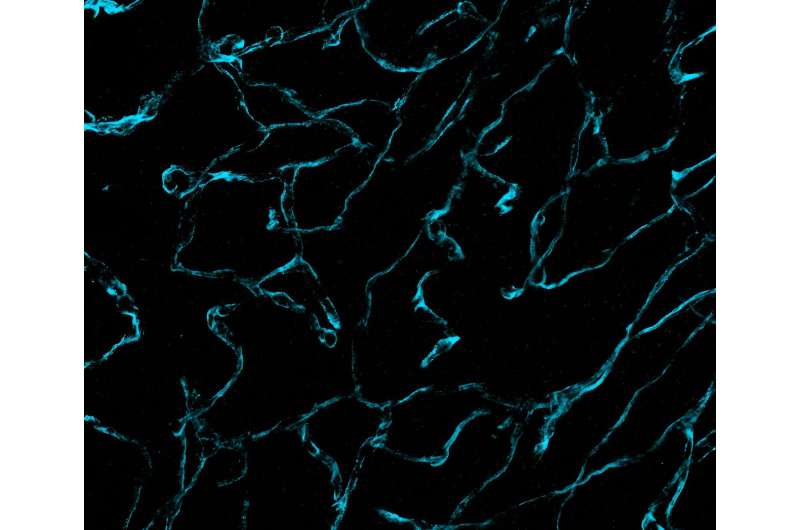
Forskere fra Brigham and Women's Hospital og Massachusetts Institute of Technology (MIT) har afsløret hidtil usete detaljerede billeder af hjernekræftvæv ved brug af en ny mikroskopiteknologi kaldet decrowding expansion pathology (dExPath). Deres resultater, offentliggjort i Science Translational Medicin , give ny indsigt i udvikling af hjernekræft, med potentielle implikationer for at fremme diagnosticering og behandling af aggressive neurologiske sygdomme.
"Tidligere har vi været afhængige af dyre, super-opløsningsmikroskoper, som kun meget velfinansierede laboratorier havde råd til, krævede specialiseret træning for at bruge og er ofte upraktiske til high-throughput analyser af hjernevæv på molekylært niveau," sagde Pablo Valdes, MD, Ph.D., en neurokirurgi bosiddende alumnus ved Brigham og hovedforfatter af undersøgelsen. "Denne teknologi bringer pålidelig billeddannelse med superopløsning til klinikken, hvilket gør det muligt for forskere at studere neurologiske sygdomme på et aldrig før opnået nanoskalaniveau på konventionelle kliniske prøver med konventionelle mikroskoper."
Forskere var tidligere afhængige af dyre mikroskoper med superhøj opløsning til at afbilde strukturer i nanoskala i celler og hjernevæv, og selv med den mest avancerede teknologi kæmpede de ofte for effektivt at fange disse strukturer på nanoskalaniveau.
Ed Boyden, Ph.D., Y. Eva Tan professor i neuroteknologi ved MIT og co-senior forfatter på denne undersøgelse, begyndte at løse dette problem ved at mærke væv og derefter kemisk modificere dem for at muliggøre ensartet fysisk ekspansion af væv. Denne ekspansionsteknologi var dog langt fra perfekt. Ved at stole på enzymer kendt som proteaser til at bryde væv op, fandt forskerne ud af, at denne kemiske behandling med enzymer ødelagde proteiner, før de kunne analysere dem, og efterlod kun et skelet af den oprindelige struktur, og kun beholdt etiketterne.
Boyden og E. Antonio Chiocca, MD, Ph.D., neurokirurgisk formand på Brigham and Women's Hospital og co-senior forfatter på denne undersøgelse, mentorede Valdes under hans uddannelse som neurokirurg-videnskabsmand for at udvikle nye kemier med dExPath. for at løse begrænsningerne ved den oprindelige ekspansionsteknologi.
Deres nye teknologi modificerer væv kemisk ved at indlejre dem i en gel og "blødgøre" vævene med en speciel kemisk behandling, der adskiller proteinstrukturer uden at ødelægge dem, og som tillader væv at udvide sig. Dette gav spændende resultater til MIT- og Brigham-forskerne, som rutinemæssigt bruger kommercielt tilgængelige antistoffer til at binde til og belyse biomarkører i en prøve.
Antistoffer er imidlertid store og kan mange gange ikke let trænge igennem cellestrukturer for at nå deres mål. Nu, ved at trække proteiner fra hinanden med dExPath, kan de samme antistoffer, der bruges til farvning, trænge ind i mellemrum for at binde proteiner i væv, som man ikke kunne få adgang til før ekspansion, og fremhæve nanometerstore strukturer eller endda cellepopulationer, der tidligere var skjult.
"Den menneskelige hjerne har adskillige stopvagter på plads for at beskytte sig selv mod patogener og miljøgifte. Men disse elementer gør det udfordrende at studere hjerneaktivitet. Det kan være lidt ligesom at køre bil gennem mudder og grøfter. Vi kan ikke få adgang til visse cellestrukturer i hjerne på grund af barrierer, der står i vejen," sagde E. Antonio Chiocca, MD, Ph.D., formand for afdelingen for neurokirurgi på Brigham. "Det er bare en af grundene til, at denne nye teknologi kunne ændre praksis. Hvis vi kan tage mere detaljerede og nøjagtige billeder af hjernevæv, kan vi identificere flere biomarkører og være bedre rustet til at diagnosticere og behandle aggressive hjernesygdomme."
For at validere effektiviteten af dExPath anvendte Boyden og Chioccas team teknologien på sundt menneskeligt hjernevæv, høj- og lavgradigt hjernekræftvæv og hjernevæv påvirket af neurodegenerative sygdomme, herunder Alzheimers og Parkinsons sygdomme. Efterforskere farvede væv for hjerne- og sygdomsspecifikke biomarkører og tog billeder før og efter udvidelse af prøver med dExPath.
Resultaterne afslørede ensartet og konsistent udvidelse af vævet uden forvrængning, hvilket muliggjorde nøjagtig analyse af proteinstrukturer. Derudover eliminerede dExPath effektivt fluorescerende signaler i hjernevæv kaldet lipofuscin, hvilket gør billeddannelse af subcellulære strukturer i hjernevæv meget vanskelig, hvilket yderligere forbedrer billedkvaliteten. Yderligere gav dExPath stærkere fluorescerende signaler til forbedret mærkning såvel som samtidig mærkning af op til 16 biomarkører i den samme vævsprøve. Navnlig afslørede dExPath-billeddannelse, at tumorer, der tidligere var klassificeret som "lavkvalitets", indeholdt mere aggressive træk og cellepopulationer, hvilket tyder på, at tumoren kunne blive langt farligere end forventet.
Selvom det er lovende, kræver dExPath validering på større prøvestørrelser, før det kan bidrage til diagnosticering af neurologiske tilstande såsom hjernekræft. Valdes understreger, at selvom det stadig er i de tidlige stadier, stræber hans team efter, at denne teknologi i sidste ende skal fungere som et diagnostisk værktøj, der i sidste ende forbedrer patientens resultater.
"Vi håber, at vi med denne teknologi bedre på nanoskalaniveauer kan forstå hjernetumorernes indviklede virkemåde og deres interaktioner med nervesystemet uden at være afhængige af ublu dyrt laboratorieudstyr," sagde Valdes, som nu er assisterende professor i neurokirurgi og Jennie. Sealy Distinguished Chair in Neuroscience ved University of Texas Medical Branch.
"Tilgængeligheden af dExPath vil give mulighed for billeddannelse i superopløsning for at forstå biologisk behandling på nanometerniveau i humant væv i neuro-onkologi og i neurologiske sygdomme som Alzheimers og Parkinsons, og en dag kan det endda forbedre diagnostiske strategier og patientresultater. "
Forfattere er Pablo Valdes (BWH og MIT), Chih-Chieh (Jay) Yu, Jenna Aronson, Debarati Ghosh, Yongxin Zhao, Bobae An (MIT), Joshua D. Bernstock (BWH og MIT), Deepak Bhere (BWH), Michelle M. Felicella, Mariano S. Viapiano, Khalid Shah (BWH) og co-korresponderende seniorforfattere E. Antonio Chiocca og Edward S. Boyden.
Flere oplysninger: Pablo Valdes et al., Forbedret immunfarvning af nanostrukturer og celler i menneskelige hjerneprøver gennem ekspansionsmedieret proteindecrowding, Science Translational Medicine (2024). DOI:10.1126/scitranslmed.abo0049
Journaloplysninger: Videnskab translationel medicin
Leveret af Brigham and Women's Hospital
 Varme artikler
Varme artikler
-
 Teknik tilbyder fremskridt inden for testning af cements trykstyrke i mikroskalaEn repræsentativ cementmikrosøjleprøve afbildet ved hjælp af scanningselektronmikroskop. Prøver som denne er nøglen til brugen af en mikropillær kompression-teknik til at karakterisere cementens mik
Teknik tilbyder fremskridt inden for testning af cements trykstyrke i mikroskalaEn repræsentativ cementmikrosøjleprøve afbildet ved hjælp af scanningselektronmikroskop. Prøver som denne er nøglen til brugen af en mikropillær kompression-teknik til at karakterisere cementens mik -
 Sammensætningsafhængighed af perovskit nanokrystal egenskaberFig. 1:Morfologiske og optiske egenskaber af FAPbBr3 PNCer. Fra:Kohærent vibrationsdynamik afslører gitteranharmonicitet i organisk-uorganisk halogenid perovskit nanokrystaller Forskere fra Skolte
Sammensætningsafhængighed af perovskit nanokrystal egenskaberFig. 1:Morfologiske og optiske egenskaber af FAPbBr3 PNCer. Fra:Kohærent vibrationsdynamik afslører gitteranharmonicitet i organisk-uorganisk halogenid perovskit nanokrystaller Forskere fra Skolte -
 En metode til at afsløre spændinger, der ændrer et materiales egenskaberGrundtanken med målemetoden:rødt lys rammer overfladen - blåt lys sendes tilbage. Kredit:Vienna University of Technology Spændinger og belastninger kan drastisk ændre et materiales egenskaber, og
En metode til at afsløre spændinger, der ændrer et materiales egenskaberGrundtanken med målemetoden:rødt lys rammer overfladen - blåt lys sendes tilbage. Kredit:Vienna University of Technology Spændinger og belastninger kan drastisk ændre et materiales egenskaber, og -
 Termiske stød ved høje temperaturer øger stabiliteten af enkeltatom-katalysatorerKatalysatorer er i bund og grund boostere, der øger hastigheden af en kemisk reaktion, og er meget udbredt inden for olieraffinering, kul og naturgas konvertering, og ammoniakproduktion, for at nævn
Termiske stød ved høje temperaturer øger stabiliteten af enkeltatom-katalysatorerKatalysatorer er i bund og grund boostere, der øger hastigheden af en kemisk reaktion, og er meget udbredt inden for olieraffinering, kul og naturgas konvertering, og ammoniakproduktion, for at nævn
- Unikt terahertz -mikroskop kan fjernbetjenes
- Uventet historisk opdagelse:Rester af berømt samisk kvinde genfundet
- De fleste forældre siger praktisk, intensivt forældreskab er bedst
- Fantastiske Webb-billeder viser det klareste blik på Cosmos nogensinde
- Direkte omdannelse af CH3Cl til eddikesyre gennem en carbonyleringsreaktion
- Undersøgelsen analyserer forudinstalleret software på Android-enheder og dens privatlivsrisici for…


