Hurtig oprensning og karakterisering af cirkulerende små ekstracellulære vesikler på en etiketfri lab-on-a-chip
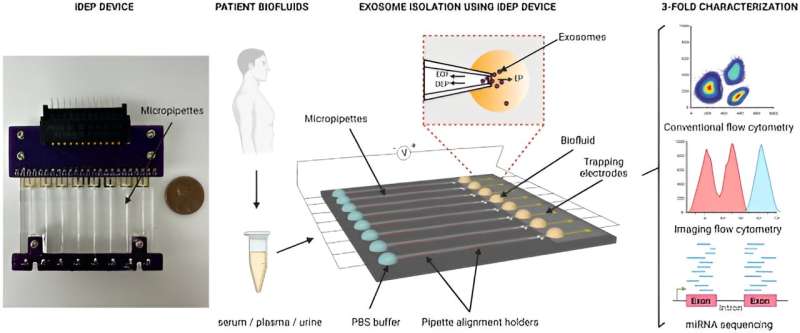
Alle celler udskiller nanoskala ekstracellulære vesikler naturligt som lipid-dobbeltlags afgrænsede partikler. Derfor er de gyldige biomarkører til at identificere en række sygdomme.
Det er vigtigt effektivt at isolere små ekstracellulære vesikler og samtidig bevare udbyttet og renheden for at udforske deres potentiale i diagnostiske, prognostiske og terapeutiske anvendelser.
Konventionelle metoder til isolering har mangler, som omfatter lav renhed og udbytte, langvarige ekstraktionsprocedurer, specialiseret udstyr og høje omkostninger.
I en undersøgelse offentliggjort i Scientific Reports , Manju Sharma og et team af forskere i biomedicinsk ingeniørvidenskab ved University of Cincinnati Ohio U.S., udviklede en ny isolatorbaseret dielektroforetisk enhed til hurtigt at isolere små ekstracellulære vesikler fra biovæsker og cellekulturmedier baseret på deres dielektriske egenskaber.
Forskerne karakteriserede de små ekstracellulære vesikler isoleret fra biovæsker fra cancerpatienter ved hjælp af instrumentet og udførte en tredobbelt karakterisering med konventionel flowcytometri, avanceret billeddannende flowcytometri og mikroRNA-sekventering for at opnå et højt udbytte af rene ekstracellulære vesikler. Platformen er effektiv til hurtigt at isolere biomarkører og opretholde den biomolekylære integritet af vesiklerne.
Membranindkapslede biologiske kar
Biologisk set er små ekstracellulære vesikler membranindkapslede biologiske kar, der findes i biovæsker såsom blod, urin, spyt, sæd, modermælk og cerebrospinalvæske; frigivet af celler ind i det ekstracellulære rum.
Sådanne nanoskala vesikler kan horisontalt overføre deres biomolekylære last til at fungere som intercellulære signalvektorer. Sådanne ekstracellulære vesikler giver en høj grad af sensitivitet og specificitet på grund af deres fremragende stabilitet. Deres tidlige påvisning i flydende biopsier kan forbedre påvisningen af kræftformer, infektioner og neurodegenerative og metaboliske sygdomme.
Isoleringen af vesiklerne er imidlertid udfordrende på grund af deres nanoskalastørrelse og fysisk-kemiske egenskaber. Isoleringsmetoder afhænger typisk af egenskaberne af de ekstracellulære vesikler, og selvom sådanne enheder har lovende egenskaber, er deres produktionsomkostninger, prøvefortynding og tilbøjelighed til tilstopning iboende udfordringer.
Som svar udviklede Sharma og kolleger en klasse af ny isolatorbaseret dielektroforetisk tilgang med mikrosøjler i mikrofluidkanaler for hurtigt at opsluge nanopartikler baseret på deres størrelse og unikke dielektriske egenskaber.
Handlingsmekanisme
Enheden opretholdt en række mikropipetter, der er i stand til at isolere nanopartikler fra små prøvevolumener ved at påføre et betydeligt lavt elektrisk felt på tværs af pipetternes længde. Arkitekturen af poregeometrien tillod isolering af ekstracellulære vesikler fra små prøvevolumener af konditionerede cellekulturmedier og biovæsker fra raske donorer.
I dette arbejde isolerede Sharma og teamet kræftpatienters biovæsker, som inkluderede serum, plasma og urin, efterfulgt af multiparametrisk karakterisering via flowcytometri og næste generations miRNA-sekventering.
-
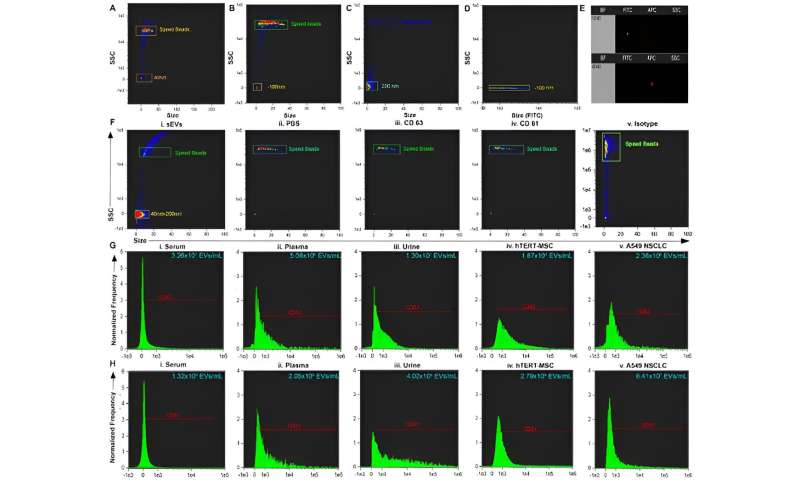
(A–C) Størrelse kontra SSC af perler og kalibreringshastighed perler. (D) Størrelse versus FITC, der illustrerer placeringen på sidespredning, der er positiv for fluorescerende perler. (E) Repræsentativt punktplot af FITC vs. scatter-intensitet (øverst) og APC vs. scatter-intensitet (nederst). (F) Repræsentativ størrelse vs. SSC-plot af i. små ekstracellulære vesikler (sEV'er) oprenset fra biofluid og negative kontroller:ii. PBS iii. antistof CD63 iv. antistof CD81 og v. isotype. (G) Repræsentativt histogram af CD63+ sEV'er fra i. serum, ii. plasma, iii. urin og positive kontroller:iv. hTERT-immortaliseret mesenkymale stamcelle (MSC) sEV'er og v. A549 ikke-småcellet lungekarcinom (NSCLC)-afledte sEV'er. (H) Repræsentativt histogram af CD81+ sEV'er fra i. serum, ii. plasma, iii. urin og positive kontroller iv. hTERT-immortaliserede MSC sEV'er og v. A549 NSCLC sEV'er. Kredit:Videnskabelige rapporter , doi:10.1038/s41598-023-45409-4 -
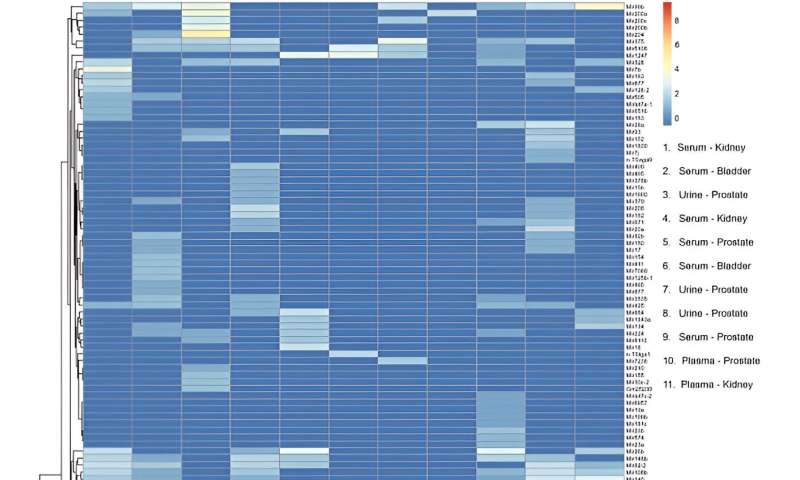
Heatmap af mikroRNA-transkripter isoleret fra serum, plasma og urin små ekstracellulære vesikler (sEV'er) fra patienter med kræft i genitourinary tract. Kolonner repræsenterer individuelle prøver. Forklaring viser typen af biovæske og kræftsted for hver prøve. Rækker repræsenterer mikroRNA-gentransskriptioner. Farvebjælkeskalaen repræsenterer miRNA-berigelse. RStudio Desktop (version 2023.06.2 + 561, tilgængelig på https://posit.co/download/rstudio-desktop/) blev brugt til generering af heatmap. Kredit:Videnskabelige rapporter , doi:10.1038/s41598-023-45409-4
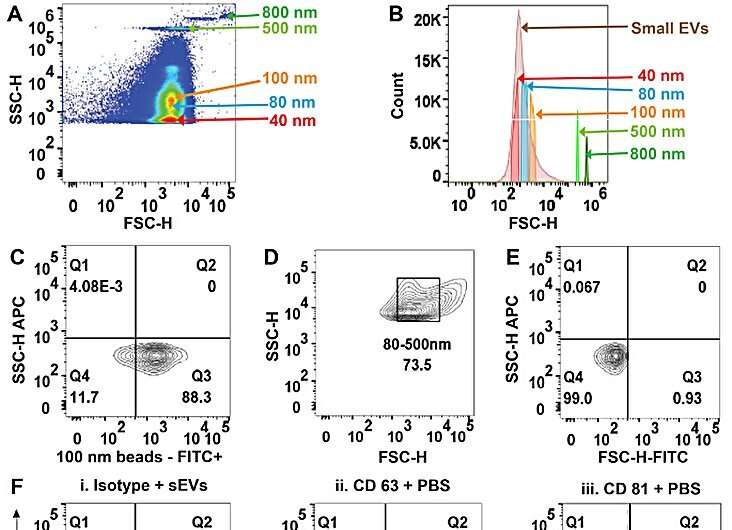
Holdet rensede små ekstracellulære vesikler fra serum, plasma og urin i fosfatbufret saltvand ved at bruge den isolatorbaserede dielektroforetiske tilgang. Sharma og kolleger brugte transmissionselektronmikroskopi til at bekræfte tilstedeværelsen af vesiklerne og udforskede multiparametrisk analyse af oprensede cirkulerende små ekstracellulære vesikler via flowcytometri.
Holdet isolerede vesiklerne og analyserede dem, efterfulgt af konventionelle flowcytometriundersøgelser. Forskerne viste yderligere kapaciteten og brugen af enheden ved at karakterisere isolaterne gennem ImageStream-software.
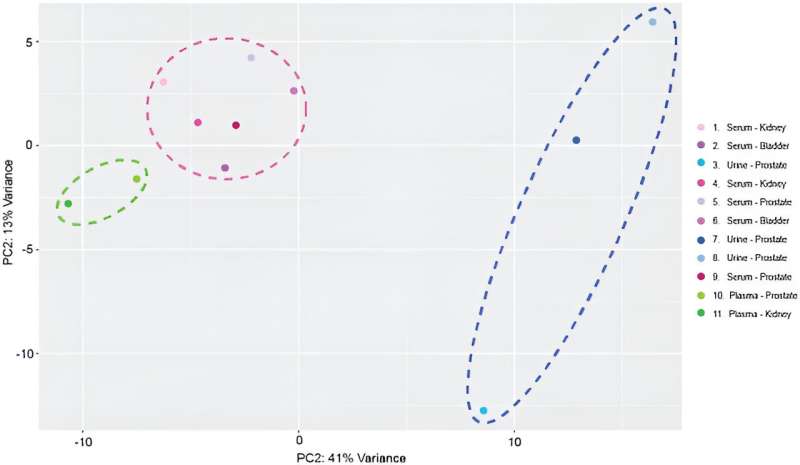
Efter miRNA-sekventering kortlagde holdet 137 distinkte, modne miRNA-transkripter til det menneskelige genom på tværs af prøver for at inkludere enheden i miRNA-biomarkøranalysearbejdsgange. De udførte transkriptomiske profiler og udførte hovedkomponentanalyse.
Outlook
På denne måde viste Manju Sharma og kolleger kapaciteten og effektiviteten af en lavspændings, etiketfri isolator-baseret dielektroforetisk enhed til at isolere små ekstracellulære vesikler fra serum, plasma og urin fra kræftpatienter gennem sub-mikron partikeldetektion, og multiparametrisk karakterisering ved brug af konventionel flowcytometri og avancerede flowcytometrimetoder.
Arbejdets RNA-koncentrationer var sammenlignelige med tidligere værker og bekræftede, at isoleringsmetoden var et levedygtigt alternativ til dem, der allerede var etableret i laboratoriet. De analytiske metoder kan være nyttige som flydende biopsiplatforme til at isolere små ekstracellulære vesikler og udvikle ekstracellulære vesikelbaserede diagnostiske og overvågningsplatforme.
Flere oplysninger: Manju Sharma et al., Hurtig oprensning og multiparametrisk karakterisering af cirkulerende små ekstracellulære vesikler ved hjælp af en etiketfri lab-on-a-chip enhed, Scientific Reports (2023). DOI:10.1038/s41598-023-45409-4
Journaloplysninger: Videnskabelige rapporter
© 2023 Science X Network
 Varme artikler
Varme artikler
-
 Nanofotoniske eksperter skaber en stærk molekylær sensorRices SECARS molekylære sensor indeholder en optisk forstærker lavet af fire guldskiver arrangeret i et diamantformet mønster. En to-kohærent-laser-opsætning forstærker de optiske signaturer af moleky
Nanofotoniske eksperter skaber en stærk molekylær sensorRices SECARS molekylære sensor indeholder en optisk forstærker lavet af fire guldskiver arrangeret i et diamantformet mønster. En to-kohærent-laser-opsætning forstærker de optiske signaturer af moleky -
 Tryk mellem lag af stablede grafenoxid-nanoark stiger med varmeNanoplader af grafenoxid udsættes for meget højt tryk, når mellemlagsafstanden forkortes ved varmebehandling. Tykkelsen af et nanoark er omkring 1 nm. (1 Å =0,1 nm =0,0000001 mm) Kredit:Ryo Ohtani
Tryk mellem lag af stablede grafenoxid-nanoark stiger med varmeNanoplader af grafenoxid udsættes for meget højt tryk, når mellemlagsafstanden forkortes ved varmebehandling. Tykkelsen af et nanoark er omkring 1 nm. (1 Å =0,1 nm =0,0000001 mm) Kredit:Ryo Ohtani -
 Fra konventionel til mærkelig metaladfærd i magisk vinkel snoet dobbeltlagsgrafenEt optisk billede af enheden skabt af forskerne. Kredit:Jaoui et al. Magic-angle twisted bilayer graphene (MATBG) er et grafenbaseret materiale med en unik struktur, bestående af to grafenplader la
Fra konventionel til mærkelig metaladfærd i magisk vinkel snoet dobbeltlagsgrafenEt optisk billede af enheden skabt af forskerne. Kredit:Jaoui et al. Magic-angle twisted bilayer graphene (MATBG) er et grafenbaseret materiale med en unik struktur, bestående af to grafenplader la -
 Lille bitte, stærkt skinnende siliciumkrystaller kunne være sikre til billeddannelse med dybt vævKlar lysemission fra siliciumkvantepunkter i en kuvette. Billedet er fra et kamera, der fanger det nær-infrarøde lys, som kvantepunkterne udsender. Den viste lysemission er en psuedo -farve, da nær-in
Lille bitte, stærkt skinnende siliciumkrystaller kunne være sikre til billeddannelse med dybt vævKlar lysemission fra siliciumkvantepunkter i en kuvette. Billedet er fra et kamera, der fanger det nær-infrarøde lys, som kvantepunkterne udsender. Den viste lysemission er en psuedo -farve, da nær-in
- De miljømæssige fordele ved en fødevaredelingsøkonomi er meget afhængig af, hvordan de sparede …
- NASA finder tropisk depression Bailu-form øst for Filippinerne
- Hvordan man laver Borax Powder
- Klimakrise:Vi er det system, der skal ændres
- Når du kommer til bunden af det arktiske havis fald:Profilering af smeltevandsfordelinger for at …
- Apple siger, at det planlægger at gøre Seattle til et nøglecenter for ingeniørarbejde med 2, 000…


