Forbedring af nanoterapeutisk vaccinelevering
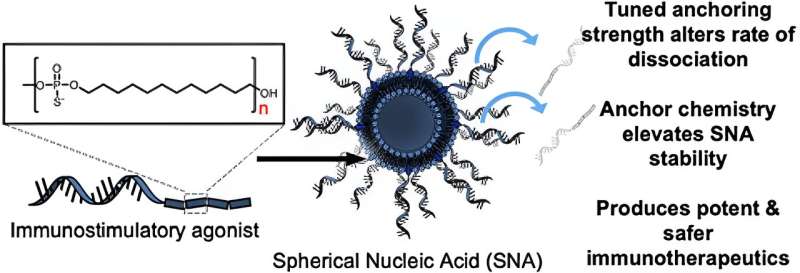
Northwestern Medicine-forskere har udviklet en mere effektiv måde at skabe nanoterapeutiske vacciner og medicin på, ifølge en ny undersøgelse offentliggjort i ACS Nano .
"I løbet af det sidste årti er sfærisk nukleinsyre eller SNA-teknologi dukket op som en bred terapeutisk platform for en lang række sygdomme, herunder kræft og andre sygdomme," siger Chad Mirkin, Ph.D., professor i medicin i afdelingen i hæmatologi og onkologi, George B. Rathmann-professor i kemi ved Northwesterns Weinberg College of Arts and Sciences og direktør for International Institute for Nanotechnology, som var hovedforfatter af undersøgelsen.
I Mirkin-laboratoriet har efterforskere udnyttet denne SNA-teknologi i deres arbejde med at designe præcisionsnanomedicin til brug i genregulering og i cancerimmunterapi med begrænsede uønskede bivirkninger gennem en systematisk udviklingsproces kendt som rationel vaccinologi.
"I udviklingen af vacciner er der historisk set meget lidt opmærksomhed på vaccinens struktur," sagde Mirkin, som også er medlem af Robert H. Lurie Comprehensive Cancer Center ved Northwestern University. "Alt fokus har været på komponenterne. Forudsætningen for rationel vaccinologi er, at selvom komponenter er kritiske, er struktur lige så vigtig. Hvordan du præsenterer vaccinekomponenter inden for en modulær nanoskalaarkitektur kan have en dramatisk indflydelse på vaccinens effektivitet, uanset om det er behandling af infektionssygdomme eller kræft."
I undersøgelsen testede efterforskerne først virkningerne af at bruge forskellige kemiske forankringsgrupper til at fastgøre oligonukleotiderne - korte DNA- eller RNA-strenge - til overfladen af liposomerne for at fremstille SNA'er. De fandt ud af, at når stadig mere hydrofobe dodecan-baserede forankringsgrupper blev brugt, blev stabiliteten af nanostrukturen væsentligt forbedret. Når de blev introduceret til knoglemarvs-afledte dendritiske celler fra mus, udviste disse mere stabile SNA-konstruktioner forbedret cellulær optagelse sammenlignet med de andre versioner af SNA'er, der blev fremstillet ved hjælp af andre typer forankringsgrupper med forskellige kemier.
"Vi opdagede en måde at forankre oligonukleotiderne til overfladen af partiklen, som ændrer den overordnede stabilitet af SNA-konstruktionen, hvilket er kritisk," sagde Jasper Dittmar, en Ph.D. studerende i Mirkin-laboratoriet og medforfatter til undersøgelsen. "Det smukke ved SNA-arkitekturen er, at den genkendes af næsten alle celletyper, immunceller inkluderet, og hurtigt internaliseres. Du får vaccinen til at trænge ind i de celler, der betyder noget ved den støkiometri, du ønsker, med det ønskede antal antigener og adjuvansmolekyler."
Forskere i Mirkin-laboratoriet fyldte derefter SNA-vaccinen med OVA1 (et modelpeptid afledt af ægprotein, der ofte bruges i vaccineudvikling) og administrerede det til mus med lymfom. De OVA1 SNA-behandlede mus havde ikke kun et større antal polyfunktionelle T-celler (som anses for potente mod kroniske infektioner og tumorer), de viste også en 21-fold reduktion i tumorvolumener sammenlignet med saltvandsbehandlede mus, ifølge studere.
For at vurdere de inflammatoriske bivirkninger af vaccinen undersøgte efterforskerne derefter SNA for at se, om det aktiverede overdreven immunrespons hos mus. Mus, der fik behandlingen, producerede ikke en cytokinstorm, en til tider dødelig bivirkning af immunterapier.
Fordi cytokinstorme er forbundet med alvorlige tilfælde af COVID-19, skabte Mirkin og hans forskerhold også en SNA-vaccine, hvor OVA1-peptidet blev byttet ud med et peptid fra den virus, der forårsager COVID-19 (CoV-peptid) og indgivet det til mennesker celler og i sidste ende mus. Efterforskerne fandt ud af, at vaccinen forstærkede antigenspecifikke anti-COVID-immunresponser med minimale negative bivirkninger.
"Tilsammen lægger resultaterne af denne undersøgelse et grundlag for en ny måde at udvikle og levere vacciner og andre præcisionsbehandlinger på, uanset målsygdommen," siger Michael Evangelopoulos, en Ph.D. studerende i Mirkin-laboratoriet og medforfatter til undersøgelsen.
Resultaterne fremhæver også vigtigheden af vaccinekonstruktion, sagde Mirkin.
"Struktur betyder noget," sagde Mirkin. "På et felt, hvor vi har brugt meget lidt tid på at fokusere på strukturen af vacciner, har vi måske manglet skoven for træerne. Det er en kombineret forståelse af komponenterne og den strukturelle præsentation, der fører til en effektiv medicin eller ej ."
Fremover vil Mirkin-gruppen fortsætte med at udtænke forskellige konfigurationer af SNA-vacciner for at vurdere, hvilke der er de mest effektive, sagde han.
"Vi bruger meget tid på at bruge SNA-platformen til at finde ud af de strukturer, der er de mest effektive, og så forsøger vi at finde ud af, hvorfor det er, hvad der virker og så også hvorfor det virker," sagde Mirkin. "Vi tror, at ved at gøre det, vil vi være i stand til at skabe en helt ny generation af medicin baseret på dette koncept om rationel vaccinologi."
Flere oplysninger: Jasper W. Dittmar et al., Tuning DNA Dissociation from Spherical Nucleic Acids for Enhanced Immunostimulation, ACS Nano (2023). DOI:10.1021/acsnano.3c04333
Journaloplysninger: ACS Nano
Leveret af Northwestern University
 Varme artikler
Varme artikler
-
 To for én i solenergiTil venstre:Dette viser laseropsætning i laboratoriet i Cambridge. Til højre:Dette er Celestia-solen. Kredit:Brina Walker Solceller giver mulighed for at høste rigeligt, vedvarende energi. Selvom
To for én i solenergiTil venstre:Dette viser laseropsætning i laboratoriet i Cambridge. Til højre:Dette er Celestia-solen. Kredit:Brina Walker Solceller giver mulighed for at høste rigeligt, vedvarende energi. Selvom -
 En ny solcreme, der ikke trænger ind i hudenKredit:Shutterstock Forskere på Yale har udviklet en solcreme, der ikke trænger ind i huden, eliminering af alvorlige sundhedsmæssige bekymringer forbundet med kommercielle solcremer. De fleste k
En ny solcreme, der ikke trænger ind i hudenKredit:Shutterstock Forskere på Yale har udviklet en solcreme, der ikke trænger ind i huden, eliminering af alvorlige sundhedsmæssige bekymringer forbundet med kommercielle solcremer. De fleste k -
 Nanocarrier spray:Bedre afgrøder uden genetisk modifikation(Venstre) Skematisk over processen. Et bioaktivt molekyle (som DNA eller RNA) kombineres med en peptidnanobærer (et cellegennemtrængende peptid, CPP) i en vandig opløsning og sprøjtes derefter på plan
Nanocarrier spray:Bedre afgrøder uden genetisk modifikation(Venstre) Skematisk over processen. Et bioaktivt molekyle (som DNA eller RNA) kombineres med en peptidnanobærer (et cellegennemtrængende peptid, CPP) i en vandig opløsning og sprøjtes derefter på plan -
 Billeder i ultrahøj opløsning af sommerfuglevingekrystaller giver fingerpeg om, hvordan strukturer…Billede af en enkelt skala fra en sommerfuglevinge, viser farveovergang fra rød til grøn. Kredit:(c) Bodo Wilts (Phys.org) – Et internationalt hold af forskere har taget endnu et skridt i retning
Billeder i ultrahøj opløsning af sommerfuglevingekrystaller giver fingerpeg om, hvordan strukturer…Billede af en enkelt skala fra en sommerfuglevinge, viser farveovergang fra rød til grøn. Kredit:(c) Bodo Wilts (Phys.org) – Et internationalt hold af forskere har taget endnu et skridt i retning
- At lave tøj af mælk
- Single-atom probe bruger kvanteinformation for første gang
- Delfinalgoritme kan føre til bedre medicinske ultralyd
- Ny miljøindikator til evaluering af produkters positive klimapåvirkninger
- Direkte oxidativ overførselsproces bidrager til vandrensning
- Uddannelse:En påvirkende faktor for intergenerationel mobilitet i Canada


