mRNA leveret af ekstracellulære vesikler inducerer immunterapirespons i glioblastom
Et team af forskere ved University of Texas MD Anderson Cancer Center har udviklet en ny metode til at bruge ekstracellulære vesikler til at forbedre respons på immunterapi ved glioblastom, hvilket potentielt åbner døren for bredere brug af manipuleret messenger RNA (mRNA) til cancerterapi. Undersøgelsen blev offentliggjort i dag i Nature Communications.
Tidligere i år udviklede et team af forskere ledet af Betty Kim, M.D., Ph.D., og Wen Jiang, M.D., Ph.D., en ny metode til indlæsning af mRNA i ekstracellulære vesikler, små strukturer skabt af celler til at transportere biomolekyler og nukleinsyrer i kroppen. Den nuværende undersøgelse bygger på denne forskning ved at demonstrere antitumorpotentialet af mRNA-ladede ekstracellulære vesikler.
mRNA-terapier, som blev anerkendt af 2023 Nobelprisen i fysiologi eller medicin, har længe haft et gennembrudspotentiale inden for patogene infektioner såvel som sygdomme som kræft. Der er dog stadig udfordringer med at levere mRNA nøjagtigt i hele kroppen. I årevis har forskere studeret potentielle leveringsmekanismer, herunder lipid eller polymere nanopartikler, men hver af disse har sine egne begrænsninger.
"Der er to primære udfordringer ved at bruge mRNA-terapier til kræftbehandling. For det første, hvordan målretter man præcist tumorcellerne i kroppen? For det andet, hvordan producerer man nok af terapien til menneskelig brug?" sagde Jiang. "Vores tilgang løser de to problemer."
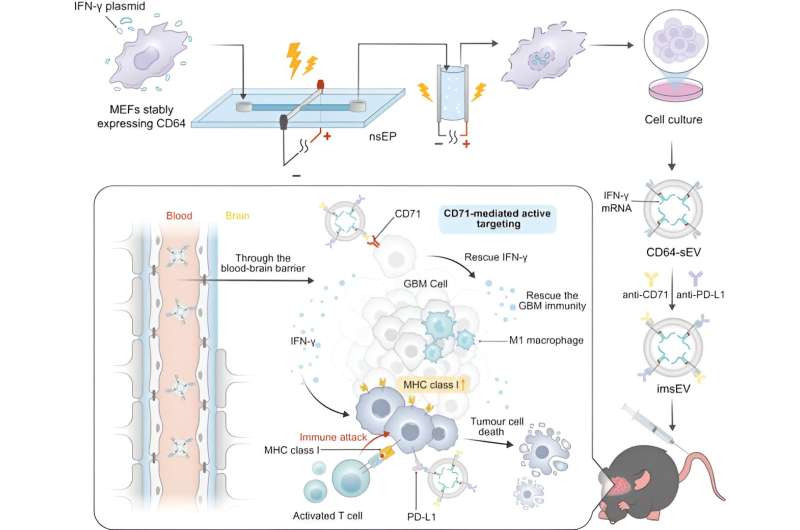
Kvantitetsproblemet løses ved at bruge et high-throughput system til at producere mRNA-ladede ekstracellulære vesikler fra konstruerede celler. Værtsceller og et designerplasmid, der koder for mRNA'et, udsættes for to ekstremt korte elektriske impulser, hvilket får membraner inde i cellen, såvel som selve cellemembranen, til at blive midlertidigt permeable. Dette får cellerne til at udskille mange ekstracellulære vesikler fyldt med mRNA-materiale, som derefter kan opsamles.
Til denne undersøgelse konstruerede forskerne de ekstracellulære vesikler til at udtrykke CD64-proteinet på deres overflade, som tjener som en dockingmekanisme til at indlæse både anti-CD71 og anti-PD-L1 antistoffer. Når de først er i kroppen, opsøger de CD71 og PD-L1, som begge er almindeligt overudtrykt i glioblastomer.
Disse ekstracellulære vesikler blev fyldt med mRNA, der koder for interferon-gamma, et immunsignalprotein. Når vesiklerne binder til receptorer på tumorceller, internaliseres de og frigiver mRNA'et.
En af grundene til, at glioblastom er vanskelig at behandle, er, at nedreguleringen af MHC-1, såvel som andre egenskaber ved tumormikromiljøet, skaber et immunsuppressivt miljø, der unddrager sig påvisning og begrænser effektiviteten af immunterapier. mRNA'et vender det, og ændrer tumormikromiljøet for at gøre tumoren påviselig for immunsystemet og mere lydhør over for immunterapier. I de prækliniske modeller blev der observeret en signifikant stigning i overlevelsestid og initial antitumoraktivitet inden for 7 dage efter injektion.
"Vi valgte glioblastom, fordi det har begrænsede behandlingsmuligheder i øjeblikket," sagde Jiang. "Vi ved, at interferon-gamma kan inducere responser på immunterapi ved glioblastom, men at levere det til tumorcellerne har indtil videre vist sig at være en stor udfordring på grund af dets halveringstid og de fleste leveringssystemers manglende evne til at krydse blod-hjerne Disse resultater baner forhåbentlig vejen for, at mRNA-ladede ekstracellulære vesikler kan bruges i cancerapplikationer."
Ifølge Jiang er en af de andre fordele ved denne tilgang, at den er plug-and-play, hvilket betyder, at den kan tilpasses til andre tumorer ved blot at ændre antistofferne til at målrette mod dem, der er overudtrykt i andre tumortyper.
Yderligere præklinisk arbejde er i gang for at fortsætte med at forbedre produktionsmetoder og profilere sikkerheden af ekstracellulære vesikler, før de anvendes i kliniske omgivelser.
Flere oplysninger: Shiyan Dong et al., Adaptivt design af mRNA-ladede ekstracellulære vesikler til målrettet immunterapi af cancer, Nature Communications (2023). DOI:10.1038/s41467-023-42365-5
Journaloplysninger: Nature Communications
Leveret af University of Texas M. D. Anderson Cancer Center
 Varme artikler
Varme artikler
-
 Drejelige kroge af grafener kemisk fætter kunne revolutionere arbejdet med elektronmikroskoperDette er en prøve set knyttet til grafenoxidet. Kredit:University of Warwick/ Nano Letters Enkeltlagsmaterialet Graphene blev genstand for en nobelpris i år, men forskning ledet af et team af fors
Drejelige kroge af grafener kemisk fætter kunne revolutionere arbejdet med elektronmikroskoperDette er en prøve set knyttet til grafenoxidet. Kredit:University of Warwick/ Nano Letters Enkeltlagsmaterialet Graphene blev genstand for en nobelpris i år, men forskning ledet af et team af fors -
 Atomisk skala billeddannelse afslører hemmeligheden bag tynd filmstyrkeAtomskala detaljer fra transmissionselektronmikroskopi, der afslører den porøse struktur af et MFI nanoark, med MEL indgroet i det. Kredit:Kumar et al., University of Minnesota Et internationalt h
Atomisk skala billeddannelse afslører hemmeligheden bag tynd filmstyrkeAtomskala detaljer fra transmissionselektronmikroskopi, der afslører den porøse struktur af et MFI nanoark, med MEL indgroet i det. Kredit:Kumar et al., University of Minnesota Et internationalt h -
 Forskerkrønike nanopartikler rejser fra lungerne ind i kroppenPå en skala fra 1 til 100 nanometer (nm) - en milliarddel af en meter - er nanopartikler for små til at være synlige gennem et traditionelt mikroskop. Men denne ekstremt lille skala gør dem til potent
Forskerkrønike nanopartikler rejser fra lungerne ind i kroppenPå en skala fra 1 til 100 nanometer (nm) - en milliarddel af en meter - er nanopartikler for små til at være synlige gennem et traditionelt mikroskop. Men denne ekstremt lille skala gør dem til potent -
 Forskere designer opladede strømdragter til elektriske køretøjer og rumfartøjerKredit:CC0 Public Domain Ligesom den opladede strømdragt, som Black Panther fra Marvel Comics bærer, har UCF-forskere avancerede NASA-teknologier til at udvikle en strømdragt til en elbil, der er s
Forskere designer opladede strømdragter til elektriske køretøjer og rumfartøjerKredit:CC0 Public Domain Ligesom den opladede strømdragt, som Black Panther fra Marvel Comics bærer, har UCF-forskere avancerede NASA-teknologier til at udvikle en strømdragt til en elbil, der er s
- Hårde grænser for eftervalg af optiske graftilstande
- Japan tester næste generations Shinkansen-kugletog
- Comcast slår Fox i Sky -auktionen med et bud på $ 39 milliarder
- Mikrostrukturen af paracetamol
- Hvordan lærer du børn at skrive sms'er? Tag teenagere med
- Tilføjelse af en inert polymer til plastsolceller muliggør høj effektivitet og let produktion


