Nanoflager af grafenoxid reducerer toksiciteten af Alzheimers proteiner, viser undersøgelse
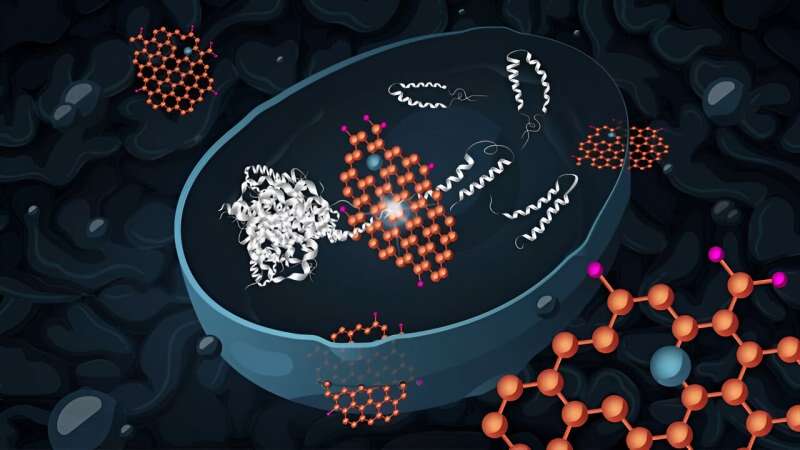
En sandsynlig tidlig årsag til Alzheimers sygdom er akkumuleringen af molekyler kaldet amyloidpeptider. Disse forårsager celledød og findes almindeligvis i hjernen hos Alzheimers patienter. Forskere ved Chalmers teknologiske universitet, Sverige, har nu vist, at gærceller, der akkumulerer disse fejlfoldede amyloidpeptider, kan komme sig efter at være blevet behandlet med grafenoxid-nanoflager.
Proteiner og peptider er grundlæggende den samme type molekyle og består af aminosyrer. Peptidmolekyler er mindre - typisk indeholdende mindre end 50 aminosyrer - og har en mindre kompliceret struktur. Proteiner og peptider kan begge blive deforme, hvis de folder sig på den forkerte måde under dannelsen i cellen. Når mange amyloid-beta-peptider akkumuleres i hjernen, klassificeres aggregaterne som proteiner.
Alzheimers sygdom er en uhelbredelig hjernesygdom, der fører til demens og død, som forårsager lidelse for både patienter og deres familier. Det anslås, at mere end 40 millioner mennesker verden over lever med sygdommen eller en beslægtet form for demens. Ifølge Alzheimer's News Today er de anslåede globale omkostninger ved disse sygdomme 1 % af det globale bruttonationalprodukt.
Misfoldede amyloid-beta-peptider, Aβ-peptider, der akkumuleres og aggregeres i hjernen, menes at være den underliggende årsag til Alzheimers sygdom. De udløser en række skadelige processer i neuronerne (hjernecellerne) – hvilket forårsager tab af mange vitale cellefunktioner eller celledød og dermed et tab af hjernefunktion i det berørte område. Til dato er der ingen effektive strategier til at behandle amyloidophobning i hjernen.
Forskere ved Chalmers University of Technology har nu vist, at behandling med grafenoxid fører til reducerede niveauer af aggregerede amyloidpeptider i en gærcellemodel. Forskningen er publiceret i tidsskriftet Advanced Functional Materials .
"Denne effekt af grafenoxid er for nylig også blevet vist af andre forskere, men ikke i gærceller," siger Xin Chen, forsker i systembiologi ved Chalmers og førsteforfatter af undersøgelsen. "Vores undersøgelse forklarer også mekanismen bag virkningen. Grafenoxid påvirker cellernes stofskifte på en måde, der øger deres modstand mod fejlfoldede proteiner og oxidativt stress. Dette er ikke tidligere blevet rapporteret."
Undersøgelse af mekanismerne ved hjælp af bagegær påvirket af Alzheimers sygdom
Ved Alzheimers sygdom udøver amyloidaggregaterne deres neurotoksiske virkninger ved at forårsage forskellige cellulære metaboliske lidelser, såsom stress i det endoplasmatiske retikulum - en stor del af cellen, hvori mange af dens proteiner produceres. Dette kan reducere cellernes evne til at håndtere fejlfoldede proteiner og dermed øge akkumuleringen af disse proteiner.
Aggregaterne påvirker også mitokondriernes funktion, cellernes kraftcenter. Derfor udsættes neuronerne for øget oxidativt stress (reaktive molekyler kaldet iltradikaler, som beskadiger andre molekyler); noget, som hjerneceller er særligt følsomme over for.
Chalmers-forskerne har udført undersøgelsen ved en kombination af proteinanalyse (proteomics) og opfølgende eksperimenter. De har brugt bagegær, Saccharomyces cerevisiae, som en in vivo-model for humane celler. Begge celletyper har meget ens systemer til kontrol af proteinkvalitet. Denne gærcellemodel blev tidligere etableret af forskergruppen for at efterligne menneskelige neuroner, der er ramt af Alzheimers sygdom.
"Gærcellerne i vores model ligner neuroner, der er påvirket af akkumulering af amyloid-beta42, som er den form for amyloidpeptid, der er mest tilbøjelig til aggregatdannelse," siger Xin Chen. "Disse celler ældes hurtigere end normalt, viser endoplasmatisk retikulumstress og mitokondriel dysfunktion og har forhøjet produktion af skadelige reaktive iltradikaler."
Store forhåbninger til grafenoxid-nanoflager
Grafenoxidnanoflager er todimensionelle kulstofnanomaterialer med unikke egenskaber, herunder enestående ledningsevne og høj biokompatibilitet. De bruges i vid udstrækning i forskellige forskningsprojekter, herunder udvikling af kræftbehandlinger, lægemiddelleveringssystemer og biosensorer.
Nanoflagerne er hydrofile (vandopløselige) og interagerer godt med biomolekyler såsom proteiner. Når grafenoxid trænger ind i levende celler, er det i stand til at forstyrre proteiners selvsamlingsprocesser.
"Som et resultat kan det hindre dannelsen af proteinaggregater og fremme opløsningen af eksisterende aggregater," siger Santosh Pandit, forsker i systembiologi ved Chalmers og medforfatter af undersøgelsen. "Vi mener, at nanoflagerne virker via to uafhængige veje for at afbøde de toksiske virkninger af amyloid-beta42 i gærcellerne."
I én vej virker grafenoxid direkte for at forhindre amyloid-beta42-akkumulering. I den anden virker grafenoxid indirekte af en (i øjeblikket ukendt) mekanisme, hvor specifikke gener for stressrespons aktiveres. Dette øger cellens evne til at håndtere fejlfoldede proteiner og oxidativ stress.
Hvordan man behandler Alzheimers patienter er stadig et spørgsmål for fremtiden. Men ifølge forskergruppen på Chalmers rummer grafenoxid et stort potentiale for fremtidig forskning inden for neurodegenerative sygdomme. Forskergruppen har allerede været i stand til at vise, at behandling med grafenoxid også reducerer de toksiske virkninger af proteinaggregater, der er specifikke for Huntingtons sygdom, i en gærmodel.
"Det næste skridt er at undersøge, om det er muligt at udvikle et lægemiddelleveringssystem baseret på grafenoxid til Alzheimers sygdom." siger Xin Chen. "Vi ønsker også at teste, om grafenoxid har gavnlige virkninger i yderligere modeller af neurodegenerative sygdomme, såsom Parkinsons sygdom."
Flere oplysninger: Xin Chen et al., Graphene Oxide dæmper toksiciteten af amyloid-β-aggregater i gær ved at fremme adskillelse og øge cellulær stressrespons, Avancerede funktionelle materialer (2023). DOI:10.1002/adfm.202304053
Journaloplysninger: Avancerede funktionelle materialer
Leveret af Chalmers University of Technology
 Varme artikler
Varme artikler
-
 Store fremskridt for fremtidens elektroniske gadgetsBrug af skjulte defekter på atomniveau kan ændre materialets ledningsevne og samtidig bevare dets strukturelle integritet. Kredit:Nanolayers Research Computing Forskere ved Norges teknisk-naturvid
Store fremskridt for fremtidens elektroniske gadgetsBrug af skjulte defekter på atomniveau kan ændre materialets ledningsevne og samtidig bevare dets strukturelle integritet. Kredit:Nanolayers Research Computing Forskere ved Norges teknisk-naturvid -
 Nano -gennembrud øger datasikkerheden(Phys.org)-Det voksende e-sikkerhedsproblem løses gennem nanoteknologi på Swinburne University of Technology. Gennembrudsforskning i fællesskab afsluttet af forskerne professor Min Gu og Dr. Xiangpin
Nano -gennembrud øger datasikkerheden(Phys.org)-Det voksende e-sikkerhedsproblem løses gennem nanoteknologi på Swinburne University of Technology. Gennembrudsforskning i fællesskab afsluttet af forskerne professor Min Gu og Dr. Xiangpin -
 Undersøgelse kaster lys over interaktioner, der ændrer den måde, varme og elektricitet bevæger s…Kredit:Massachusetts Institute of Technology Ny forskning giver indsigt i, hvordan krystaldislokationer - en almindelig type defekt i materialer - kan påvirke elektrisk og varmetransport gennem kr
Undersøgelse kaster lys over interaktioner, der ændrer den måde, varme og elektricitet bevæger s…Kredit:Massachusetts Institute of Technology Ny forskning giver indsigt i, hvordan krystaldislokationer - en almindelig type defekt i materialer - kan påvirke elektrisk og varmetransport gennem kr -
 Lær at finjustere nanofabrikationEn dannelse af kædeformede strukturer på en kobberoverflade fra molekylær selvsamling, som forudsagt af en ny beregningsmetode. Disse kædeformede strukturer kan fungere som små tråde med diametre 1/10
Lær at finjustere nanofabrikationEn dannelse af kædeformede strukturer på en kobberoverflade fra molekylær selvsamling, som forudsagt af en ny beregningsmetode. Disse kædeformede strukturer kan fungere som små tråde med diametre 1/10
- Tegn på liv på Mars? Perseverance rover begynder jagten
- Risfysikere RAMBO afslører magnetiske fænomener, der er nyttige til kvantesimulering og sansning
- Forskere bygger masseproducerbare miniature kvantehukommelseselementer
- Første neutronstråle produceret:En stor milepæl for China Spallation Neutron Source
- Sådan finder du omkretsen af en cirkel
- Hvorfor krøller gulerødder? Forskning afslører mekanikken bag ældning af rodfrugter


