Forskere udfordrer mangeårig teori, der vejleder nanopartikelbehandling af tumorer

Forskere ved University of Toronto har udviklet en ny teori til at forklare, hvordan nanopartikler kommer ind og ud af de tumorer, de er beregnet til at behandle, hvilket potentielt omskriver en forståelse af cancer nanomedicin, der har været vejledende for forskning i næsten fire årtier.
Effekten Enhanced Permeability and Retention (EPR), et koncept stort set uanfægtet siden midten af 1980'erne, hævder, at nanopartikler kommer ind i en tumor fra blodbanen gennem huller mellem endotelcellerne, der beklæder dens blodkar - og derefter bliver fanget i tumoren pga. dysfunktionelle lymfekar.
"Retentionsaspektet af EPR-teorien er betinget af, at lymfekarhulen er for lille til, at nanopartikler kan komme ud, og derved hjælper nanopartikler, der bærer kræftbekæmpende lægemidler, til at blive i tumorerne," sagde Matthew Nguyen, en Ph.D. studerende ved Institut for Biomedicinsk Teknik ved Fakultetet for Anvendt Videnskab og Teknik og Donnelly Center for Cellular and Biomolecular Research,
"Men vi fandt ud af, at omkring 45 procent af nanopartikler, der akkumuleres i tumorer, vil ende med at forlade dem."
Nguyen, som er medlem af professor Warren Chans laboratorium, er hovedforfatter på en ny undersøgelse, der for nylig er offentliggjort i tidsskriftet Nature Materials der udfordrer den mangeårige teori. Forskernes resultater hjælper med at forklare, hvorfor behandlinger baseret på EPR-effekten fejler i kliniske forsøg, baseret på tidligere forskning fra Chan-laboratoriet, der viste, at mindre end én procent af nanopartikler rent faktisk når tumorer.
Forskerne fandt ud af, at i modsætning til EPR-effekten kan nanopartikler efterlade tumorer gennem deres lymfekar. Udgangsmetoden for en nanopartikel afhænger af dens størrelse, med større (50-100 nanometer brede) mere tilbøjelige til at forlade lymfekar i tumorerne, og mindre (op til 15 nanometer brede) mere tilbøjelige til at forlade lymfekar omkring tumorerne.
I sjældne tilfælde vil nanopartikler komme ud gennem blodkarrene.
Nanopartikeludgang fra tumorer sker gennem rum i lymfekarvæggene og transportvesikler, der bærer dem på tværs af disse vægge. Forskerne viste, at nanopartikler vil genindtræde i blodbanen efter lymfedrænage, og antog, at disse nanopartikler i sidste ende vil vende tilbage til tumoren for endnu en mulighed for at behandle den.
At modbevise EPR-effekten var ikke nogen let bedrift. Chan-laboratoriet brugte seks år på at arbejde for at forstå, hvorfor nanopartikler ikke akkumuleres effektivt i tumorer. Forud for denne undersøgelse fokuserede laboratoriet på, hvordan nanopartikler kommer ind i tumorer i første omgang. Gennem denne og andre undersøgelser udviklede laboratoriet en konkurrerende teori til EPR-effekten, kaldet Active Transport and Retention (ATR) princippet.
Nguyen bemærkede, at området for nanomedicin har udviklet sig siden offentliggørelsen af undersøgelsen af nanopartikelindgang i 2020. "Vi fik mere tilbageslag fra andre forskere på det studie sammenlignet med denne," sagde han. "Folk er begyndt at acceptere, at EPJ-effekten er mangelfuld."
Med næsten halvdelen af akkumulerede nanopartikler, der forlader tumorer, for det meste gennem lymfekar, kan fremtidig forskning løse dette problem gennem nanopartikelbehandlinger, der forhindrer lymfedrænage.
"Vi er glade for at have en bedre forståelse af nanopartikeltumorleveringsprocessen," sagde Chan. "Resultaterne af disse grundlæggende undersøgelser af nanopartiklers ind- og udtræden vil være vigtige for konstruktion af nanopartikler til behandling af kræft."
Undersøgelsens resultater, hvis de anvendes på tværs af kræft-nanomedicin, lover en ny retning for at forbedre vores forståelse af, hvordan nanopartikler kan bruges til at behandle tumorer.
"At forsøge at oversætte kræft nanomedicin til klinikken er som at arbejde med en sort boks - nogle stoffer virker, nogle gør ikke, og det er svært at vide hvorfor," siger Gang Zheng, associeret forskningsdirektør ved Princess Margaret Cancer Center og en professor i medicinsk biofysik ved U of T's Temerty Faculty of Medicine, som ikke var involveret i undersøgelsen.
"Chans dedikation til bedre at forstå mekanismerne for nanopartikeloptagelse og -udgang skinner lys på disse processer for at hjælpe med at gøre vores oversættelsesindsats mere effektiv og succesfuld."
Flere oplysninger: Luan N. M. Nguyen et al, Nanopartiklers udgang fra solide tumorer, Naturmaterialer (2023). DOI:10.1038/s41563-023-01630-0
Journaloplysninger: Naturmaterialer
Leveret af University of Toronto
 Varme artikler
Varme artikler
-
 Lille robot nano-fisk kan en dag levere stoffer inde i kroppenKredit: Lille (2016). DOI:10.1002/smll.201601846 (Phys.org) – Et kombineret team af forskere fra Harbin Institute of Technology i Kina og University of California i USA har udviklet en nano-størr
Lille robot nano-fisk kan en dag levere stoffer inde i kroppenKredit: Lille (2016). DOI:10.1002/smll.201601846 (Phys.org) – Et kombineret team af forskere fra Harbin Institute of Technology i Kina og University of California i USA har udviklet en nano-størr -
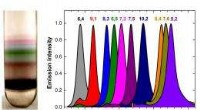 Nano parfait en godbid for videnskabsmændI to nye aviser, Rice University-forskere rapporterer, at de bruger ultracentrifugering (UCF) til at skabe højt oprensede prøver af kulstofnanorørarter. Et hold, ledet af risprofessor Junichiro Kono
Nano parfait en godbid for videnskabsmændI to nye aviser, Rice University-forskere rapporterer, at de bruger ultracentrifugering (UCF) til at skabe højt oprensede prøver af kulstofnanorørarter. Et hold, ledet af risprofessor Junichiro Kono -
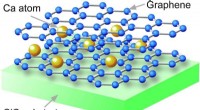 Grafen bliver superledende - Elektroner uden massestrøm uden modstandFig1. Krystalstruktur af Ca-interkaleret dobbeltlagsgrafen fremstillet på SiC-substrat. Indsættelse af Ca-atomer mellem to grafenlag forårsager superledningsevnen. Grafen er en enkeltatomisk kulst
Grafen bliver superledende - Elektroner uden massestrøm uden modstandFig1. Krystalstruktur af Ca-interkaleret dobbeltlagsgrafen fremstillet på SiC-substrat. Indsættelse af Ca-atomer mellem to grafenlag forårsager superledningsevnen. Grafen er en enkeltatomisk kulst -
 Nanoteknik forbedrer ladningstransporten, lover mere effektive fremtidige solcellerNano-carbon enhed (Phys.org) – Solceller baseret på halvledende kompositplast og kulstofnanorør er en af de mest lovende nye teknologier til fremstilling af billige printede solceller. Fysikere
Nanoteknik forbedrer ladningstransporten, lover mere effektive fremtidige solcellerNano-carbon enhed (Phys.org) – Solceller baseret på halvledende kompositplast og kulstofnanorør er en af de mest lovende nye teknologier til fremstilling af billige printede solceller. Fysikere


