Sniffning af nanopartikler fyldt med mRNA kan føre til avanceret lungeterapi
Forskere ved Yale University, New Haven, har optimeret en polymer-baseret mRNA-vehikel til målrettet lungelevering og demonstreret potentialet i platformen for slimhindevaccination mod respiratoriske patogener.
I et papir, "Polymer nanopartikler leverer mRNA til lungen til slimhindevaccination," offentliggjort i Science Translational Medicine , introducerer holdet deres skabelse af inhalerbart messenger-RNA (mRNA) til terapeutisk brug.
Klinisk forskning har søgt efter en effektiv og målrettet måde at levere mRNA til lungerne til forskellige terapeutiske anvendelser, herunder proteinerstatningsterapier, genredigering og vaccination. De største udfordringer har været at opretholde mRNA-stabilitet og undgå immuninterferens.
Yale-teamet skabte PACE (Polymerized Albumin Conjugates for mRNA Encapsulation) polymerformuleringer til at levere lokalt mRNA til lungerne. Forskerne optimerede PACE-polyplekser for at forbedre mRNA-beskyttelse, transfektionseffektivitet og antigenpræsentation til effektive lungespecifikke terapeutiske og vaccinationsstrategier.
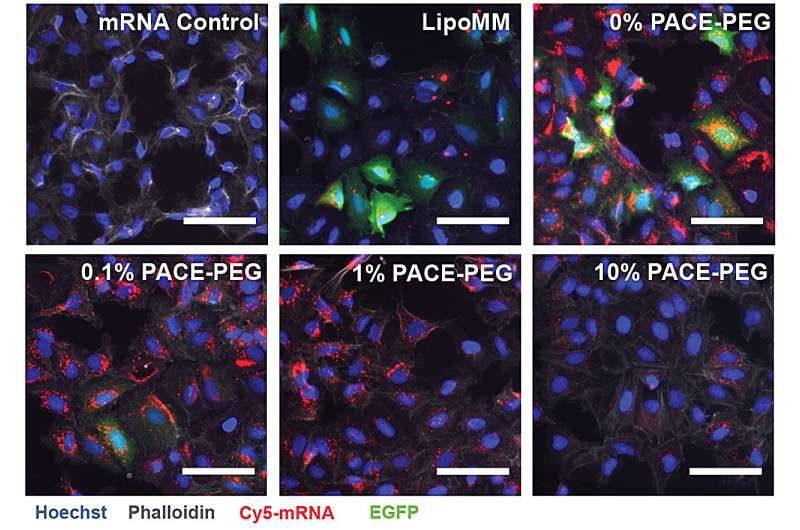
For at stabilisere PACE blev et optimeret forhold mellem polyethylenglycol (PEG) molekyler integreret i polymerstrukturen under den enzymatiske copolymerisationsproces, som stabiliserede polyplekserne og modificerede nøglekarakteristika. PEG var i stand til at påvirke størrelsen, overfladeladningen og andre egenskaber af polyplekserne, hvilket gjorde dem mere egnede til lastning og effektive ved mRNA-levering til lungeceller.
Den stabiliserede formulering fungerede dårligt i et in vitro cellekultureksperiment. Forskerne bemærker, at traditionelle cellekulturmetoder ikke er gode forudsigere for leveringssystemer, hverken positivt eller negativt. Miljøet i kroppen, især lungerne, interagerer meget anderledes end en samling af celler. For eksempel mangler slimhinderne, og disse overflader er præcis, hvad PACE-PEG-systemet er designet til at udnytte. Den rigtige test ville komme in vivo med en musemodel.
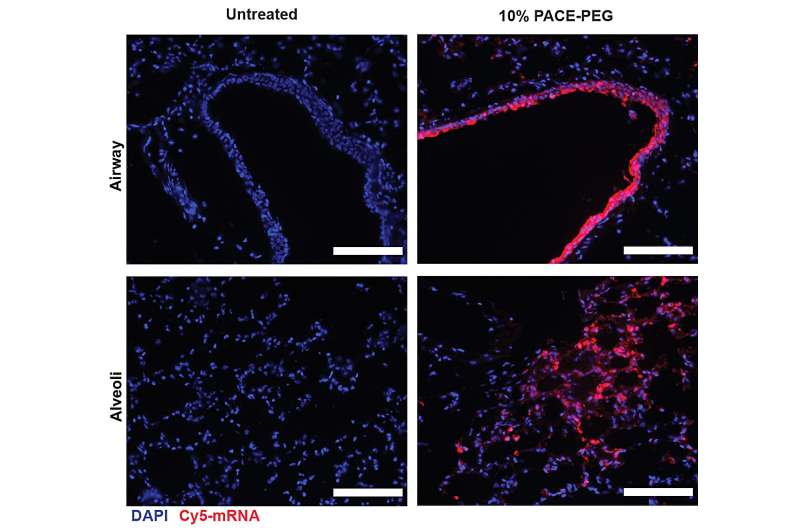
Forskerne indkapslede mRNA, der koder for spikeproteinet fra SARS-CoV-2 i PACE og inokulerede mus, der var modtagelige for SARS-CoV-2-infektion. Mus modtog en dosis på 10 μg PACE-mRNA leveret intranasalt på dag 0 og 28. Udviklingen af adaptiv immunitet i de mediastinale lymfeknuder blev testet og bekræftet 14 dage efter boostet.
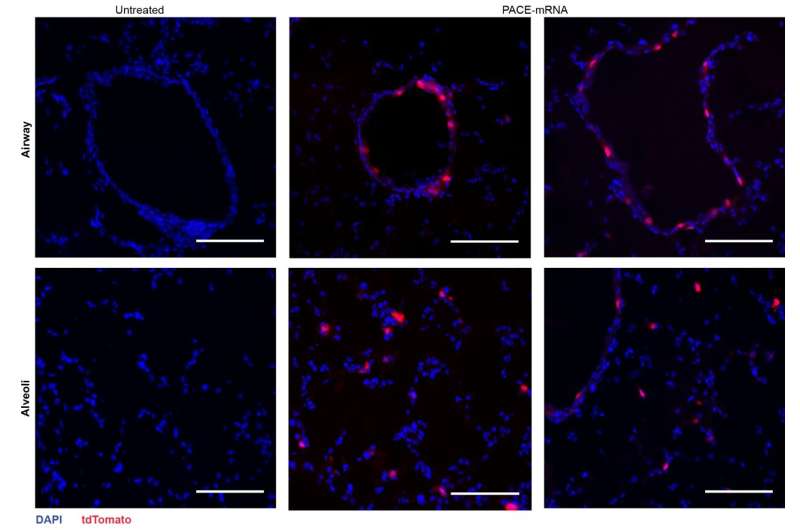
Efter at have vurderet det lokale immunrespons undersøgte forskerne lungevæv, blodserum og bronchoalveolær skyllevæske for lokale og systemiske antigenspecifikke T-celle- og antistofresponser. Transfektion forekom primært i lungeepitelceller og antigenpræsenterende celler, to celletyper, der er relevante mål for lungesygdomme
Vaccinationen med succes øgede spike protein-specifikke CD8 + T-celler i lungevævet og cirkulerende CD8 + T-celler i blodbanen. CD8 + T-celler udtrykte markører, der indikerer vævsresident hukommelse. Både cirkulerende og slimhinde-IgG-antistoffer blev fundet i signifikant højere koncentrationer i vaccinerede mus.
Mus blev derefter introduceret til en dødelig dosis af SARS-CoV-2. PACE-mRNA-vaccination reducerede signifikant virusbyrden i lungerne og forbedrede vægten og overlevelsen af de vaccinerede mus. Denne beskyttelse blev tilskrevet det spidsproteinspecifikke immunrespons, der blev induceret af vaccinationen.
Kontrolgruppen viste ingen tegn på et spidsproteinspecifikt immunrespons og udviste ikke reduceret viral belastning eller forbedret overlevelse efter den virale udfordring.
Studiet præsenterer PACE-mRNA-polyplekser som en lovende metode til effektiv og målrettet mRNA-levering til lungerne med potentielle fordele for både terapeutisk proteinekspression og slimhindevaccination mod respiratoriske patogener.
Undersøgelsen illustrerer også betydningen af dyremodeller i modsætning til cellekultur alene til at bestemme virkningerne i den virkelige verden. De positive resultater indikerer, at mere forskning er berettiget, med yderligere testning planlagt på større dyremodeller.
Flere oplysninger: Alexandra Suberi et al, Polymer nanopartikler leverer mRNA til lungen til slimhindevaccination, Science Translational Medicine (2023). DOI:10.1126/scitranslmed.abq0603
Journaloplysninger: Videnskab translationel medicin
© 2023 Science X Network
 Varme artikler
Varme artikler
-
 Små robotter drevet af magnetiske felter kan hjælpe nanopartikler til at nå deres målVision om forbedret transport af nanomedicin ind i tumorvæv. Kredit:Sonia Monti MIT-ingeniører har designet bittesmå robotter, der kan hjælpe nanopartikler, der leverer lægemidler, med at skubbe d
Små robotter drevet af magnetiske felter kan hjælpe nanopartikler til at nå deres målVision om forbedret transport af nanomedicin ind i tumorvæv. Kredit:Sonia Monti MIT-ingeniører har designet bittesmå robotter, der kan hjælpe nanopartikler, der leverer lægemidler, med at skubbe d -
 En ny teknik til fremstilling af spændende metaloxidskeletterAalto Metal oxid rammer, eller MOFer, er solide materialer, der kan opføre sig som ultrafine svampe. Hulrummene i svampen er af nanostørrelse - omtrent på størrelse med individuelle molekyler. At
En ny teknik til fremstilling af spændende metaloxidskeletterAalto Metal oxid rammer, eller MOFer, er solide materialer, der kan opføre sig som ultrafine svampe. Hulrummene i svampen er af nanostørrelse - omtrent på størrelse med individuelle molekyler. At -
 Nanopartikler kan begrænse inflammation ved at distrahere immunsystemetNeutrofiler (røde) binder til de plastiske nanopartikler (grønne) inde i et levende museblodkar. Kredit:Catherine Fromen, Celleadhæsion og lægemiddelleveringslaboratorium, University of Michigan.
Nanopartikler kan begrænse inflammation ved at distrahere immunsystemetNeutrofiler (røde) binder til de plastiske nanopartikler (grønne) inde i et levende museblodkar. Kredit:Catherine Fromen, Celleadhæsion og lægemiddelleveringslaboratorium, University of Michigan. -
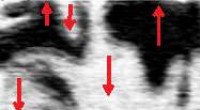 Undersøgelse af ferroelektriske domænevægge tilbyder en ny ledningsvej i nanoskalaSPM-billeder af (110) overfladen af spaltet h-HoMnO3. (øverst) PFM-billede, der viser ferroelektriske domæner i planet (orienteret lodret, røde pile). (nederst) cAFM-billede, der viser forbedret led
Undersøgelse af ferroelektriske domænevægge tilbyder en ny ledningsvej i nanoskalaSPM-billeder af (110) overfladen af spaltet h-HoMnO3. (øverst) PFM-billede, der viser ferroelektriske domæner i planet (orienteret lodret, røde pile). (nederst) cAFM-billede, der viser forbedret led
- Rygsækrejsende er bekymrede for at bruge mobile enheder i Ghana
- University of California sygeplejersker, lægearbejdere melder sig i strejke
- Fiat-Chrysler og GM går sammen med Ford om at skære i produktionen efter anlægsbrand
- Teamet udvikler metode til neurale netberegninger i vand
- Hvad sker der, når et stof opløses i vand?
- Hvad er blandede tidevand?


