Sådan måler man fusionsvarme på Ice
"Varme" repræsenterer molekylernes termiske energi i et stof. Vandet fryser ved 0 grader Celsius. Men temperaturen på en isterning kan falde langt under det. Når en isterning fjernes fra en fryser, øges terningens temperatur, da den absorberer varme fra omgivelserne. Men når isterningen når 0 C, begynder den at smelte og dens temperatur forbliver ved 0 i hele smelteprocessen, selvom isterningen fortsætter med at absorbere varme. Dette skyldes, at den termiske energi absorberet af isteren forbruges af vandmolekyler, som adskiller sig fra hinanden under smeltning.
Mængden af varme absorberet af et fast stof under dets smeltefase er kendt som den latente fusionsvarme og måles via kalorimetri.
Dataindsamling
Placer en tom Styrofoam-kop på en balance og optag massen af den tomme kop i gram. Derefter fyldes koppen med ca. 100 ml, eller ca. 3,5 ounce, destilleret vand. Returner den fyldte kop til balancen og registrer vægten af koppen og vandet sammen.
Placer et termometer i vandet i koppen, vent ca. 5 minutter for termometeret til at komme til termisk ligevægt med vandet, Indtast derefter vandets temperatur som indledende temperatur.
Placer to eller tre isterninger på et papirhåndklæde for at fjerne eventuelt flydende vand på overfladerne af terningerne og derefter hurtigt overføre terningerne til Styrofoam-koppen. Brug termometeret til forsigtigt omrøring af blandingen. Overhold temperaturlæsningen på termometeret. Det skal begynde at falde næsten øjeblikkeligt. Fortsæt omrøring og optag den laveste temperatur angivet på termometeret, før temperaturen begynder at stige. Optag denne værdi som "sluttemperatur."
Fjern termometeret og returner Styrofoam-cupen igen til balancen og optag massen af koppen, vandet og smeltet is sammen.
Beregninger
Bestem vandets masse i koppen ved at trække den tomme kops masse fra vægten af koppen og vandet sammen, som samlet i trin 1. Hvis den tomme kop vejer 3,1 gram og kop og vand sammen vejede 106,5 gram, så vandets masse var 106,5 - 3,1 = 103,4 g.
Beregn temperaturændringen af vandet ved at trække den indledende vandtemperatur fra den endelige vandtemperatur. Således, hvis den indledende temperatur var 24,5 ° C og den endelige temperatur var 19,2 ° C, så blev deltaT = 19,2-24,5 = -5,3 ° C.
Beregn varmen q, fjernet fra vandet i overensstemmelse med ligningen q = mc (deltaT), hvor m og deltaT repræsenterer henholdsvis massens og temperaturændringen af vandet, og c repræsenterer vandets specifikke varmekapacitet, eller 4,184 joules pr. gram pr. grad Celsius eller 4,187 J /gC. Fortsættelse af eksemplet fra trin 1 og 2, q = ms (deltaT) = 103,4 g * 4,184 J /g-C * -5,3 C = -2293 J. Dette repræsenterer varmen fjernet fra vandet og dermed dets negative tegn. Ved termodynamikloven betyder det, at isbiterne i vandet absorberer +2293 J af varme.
Bestem isbjælkernes masse ved at trække koppens og vandets masse fra kopens masse , vand og isterninger sammen. Hvis koppen, vand og is sammen vejede 110,4 g, var isbjælkernes masse 110,4 g - 103,4 g = 7,0 g.
Find den latente fusionsvarme Lf, ifølge Lf = q ÷ m ved at dividere varmen q, absorberet af isen som bestemt i trin 3 ved massen af is, m, bestemt i trin 4. I dette tilfælde er Lf = q /m = 2293 J ÷ 7,0 g = 328 J /g. Sammenlign dit eksperimentelle resultat med den accepterede værdi på 333,5 J /g.
TL; DR (for lang, ikke læst)
Hvis du har brug for den latente fusionsvarme i andre enheder end joules per gram, såsom kalorier pr. gram, brug et værktøj til konvertering af online-enheder, som den, der findes i afsnittet Ressourcer.
Sidste artikelSådan fjerner du chlor fra vand
Næste artikelHvilke brød formes hurtigere?
 Varme artikler
Varme artikler
-
 Svovlsyre & klorreaktionKlorblekemiddel er en opløsning af natriumhypochlorit og vand. Klorgas produceres, når svovlsyre blandes med klorblekemiddel. Denne reaktion er en funktion af ændringen i pH i opløsningen fra alkal
Svovlsyre & klorreaktionKlorblekemiddel er en opløsning af natriumhypochlorit og vand. Klorgas produceres, når svovlsyre blandes med klorblekemiddel. Denne reaktion er en funktion af ændringen i pH i opløsningen fra alkal -
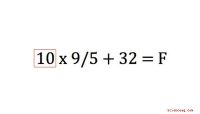 Sådan konverteres Celsius til FahrenheitTrods den metriske konverteringslov fra 1975 forbliver USA et af de få lande, der stadig bruger Fahrenheit-temperaturskalaen. Forskere overalt, herunder i USA, arbejder dog med Celsius temperatur skal
Sådan konverteres Celsius til FahrenheitTrods den metriske konverteringslov fra 1975 forbliver USA et af de få lande, der stadig bruger Fahrenheit-temperaturskalaen. Forskere overalt, herunder i USA, arbejder dog med Celsius temperatur skal -
 Sådan beregnes bindingsvinklerForudsig vinklerne mellem bundne atomer ved hjælp af teorien om valensskallelektronparafvisning (VSEPR). Det steriske antal - summen af andre atomer og ensomme elektronpar, der er bundet til et cent
Sådan beregnes bindingsvinklerForudsig vinklerne mellem bundne atomer ved hjælp af teorien om valensskallelektronparafvisning (VSEPR). Det steriske antal - summen af andre atomer og ensomme elektronpar, der er bundet til et cent -
 Sådan fremstilles en fem procent opløsning med SaltEn saltopløsning, også kaldet en saltopløsning, er simpelthen en blanding af salt og vand. Salt er det opløste stof (det opløselige stof), og vand er opløsningsmidlet (det stof, der opløser en anden f
Sådan fremstilles en fem procent opløsning med SaltEn saltopløsning, også kaldet en saltopløsning, er simpelthen en blanding af salt og vand. Salt er det opløste stof (det opløselige stof), og vand er opløsningsmidlet (det stof, der opløser en anden f


