Hvorfor konvergerer linjerne ved høje frekvenser i emissionsspektret?
1. Kvantiserede energiniveau:
* Atomer har diskrete energiniveau, hvilket betyder, at elektroner kun kan eksistere i specifikke energitilstande, ikke derimellem. Disse energiniveauer er kvantiseret, repræsenteret af hovedkvantetal (n =1, 2, 3 osv.).
2. Overgange og emission:
* Når en elektron hopper fra et højere energiniveau til et lavere, frigiver den energi i form af en foton.
* Energien fra den udsendte foton er lig med forskellen i energi mellem de to niveauer:ΔE =e₂ - e₁.
3. Frekvens og energi:
* Energien fra en foton er direkte proportional med dens frekvens (F) i henhold til ligningen:E =HF, hvor H er Plancks konstante.
4. Konvergens ved høje frekvenser:
* Når energiforskellen mellem niveauer (ΔE) stiger, har de udsendte fotoner højere frekvenser.
* Når vi går til højere energiniveau (N), falder afstanden mellem tilstødende niveauer. Dette betyder, at energiforskellen mellem på hinanden følgende niveauer bliver mindre og mindre, når N øges.
* Derfor har de udsendte fotoner i stigende grad ensfrekvenser, hvilket resulterer i, at de spektrale linjer vises tættere sammen.
* Når energiniveauet nærmer sig uendelighed, bliver afstanden mellem niveauer i det væsentlige nul. Dette resulterer i, at emissionslinjerne konvergerer til et kontinuerligt spektrum ved ekstremt høje frekvenser, kaldet -seriegrænsen .
Eksempel:Balmer -serien
I Balmer -serien af brintspektret overgår elektroner til n =2 energiniveauet fra højere niveauer (n =3, 4, 5 osv.). Linjerne konvergerer til en seriegrænse, når N nærmer sig uendelighed.
Kortfattet: Konvergensen af linjer i et emissionsspektrum ved høje frekvenser afspejler de faldende energiforskelle mellem højere energiniveau og spektret kontinuerlig karakter ved ekstremt høje frekvenser, som forudsagt af kvantemekanik.
Sidste artikelGruppen PF -stjerner, der inkluderer solen?
Næste artikelHvorfor er Venus vigtig for solsystemet?
 Varme artikler
Varme artikler
-
 NASAs Curiosity-team navngiver Mars-bakke, der fungerer som missionsportKredit:NASAs Goddard Space Flight Center Holdet af videnskabsmænd og ingeniører bag NASAs Curiosity-rover navngav en bakke langs roverens sti på Mars til ære for en nyligt afdød missionsforsker. E
NASAs Curiosity-team navngiver Mars-bakke, der fungerer som missionsportKredit:NASAs Goddard Space Flight Center Holdet af videnskabsmænd og ingeniører bag NASAs Curiosity-rover navngav en bakke langs roverens sti på Mars til ære for en nyligt afdød missionsforsker. E -
 Ultra-høj-energi gammastråler stammer fra pulsar-tågerEfter at have opdaget ni ultra-højenergi gammastrålekilder i 2020, forskere ved High Altitude Water Cherenkov Observatory (HAWC) udnyttede anlæggets brede synsfelt og undersøgelsesmuligheder til at fa
Ultra-høj-energi gammastråler stammer fra pulsar-tågerEfter at have opdaget ni ultra-højenergi gammastrålekilder i 2020, forskere ved High Altitude Water Cherenkov Observatory (HAWC) udnyttede anlæggets brede synsfelt og undersøgelsesmuligheder til at fa -
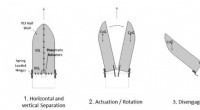 Nyt raketbeklædningsdesign giver en mere jævn og rolig kørselLavt stød-beklædningsadskillelse og sprøjtesystem. Kredit:RUAG Space Satellitter er bygget til at leve i det barske miljø i rummet, men ingeniører skal også tage hensyn til strabadserne på rejsen
Nyt raketbeklædningsdesign giver en mere jævn og rolig kørselLavt stød-beklædningsadskillelse og sprøjtesystem. Kredit:RUAG Space Satellitter er bygget til at leve i det barske miljø i rummet, men ingeniører skal også tage hensyn til strabadserne på rejsen -
 Japans firma underskriver med SpaceX for månemissionerDet japanske firma håber at sende to missioner til månen En japansk start-up skal sende rumfartøjer til månen i en aftale underskrevet med Elon Musks SpaceX, sagde det Tokyo-baserede firma onsdag.
Japans firma underskriver med SpaceX for månemissionerDet japanske firma håber at sende to missioner til månen En japansk start-up skal sende rumfartøjer til månen i en aftale underskrevet med Elon Musks SpaceX, sagde det Tokyo-baserede firma onsdag.
- Hvilket organ i kroppen er ikke en permeabel membran?
- Sort historiemåned er ikke kun en tid til at fejre marcher og martyrer
- Er registrerede observationer og videnskabelige resultater den samme ting?
- Forskere dokumenterer en anden omkostning ved valget i 2016:Kortere Thanksgiving-besøg
- Hvordan lærere ville håndtere elevers vold mod pædagoger
- En falsk Facebook-konto afslører, hvordan vi falder for falske nyheder


