Hvordan bestemmes formen på en elektronsky?
Her er en sammenbrud:
1. Hovedkantenummer (n): Dette antal bestemmer elektronens energiniveau. Højere værdier på * n * svarer til højere energiniveauer og større elektronskyer.
2. Angular Momentum Quantum Number (L): Dette tal definerer formen på elektronskyen. Det kan variere fra 0 til *n *-1.
* l =0: s orbital - sfærisk form
* l =1: p orbital - håndvægtsform
* l =2: d orbital - Mere komplekse former med lober og knudepunkter
* l =3: f orbital - Endnu mere komplekse former
3. Magnetisk kvantetal (ML): Dette nummer beskriver orienteringen af orbitalen i rummet. For en given*l*er der 2*l*+1 mulige værdier af*ml*, hvilket fører til forskellige orienteringer af samme form.
4. Spin Quantum Number (MS): Selvom dette nummer ikke direkte påvirker formen, beskriver det elektronets iboende vinkelmoment, der kvantificeres og kaldes spin.
hvordan det fungerer:
* schrödinger ligning , en grundlæggende ligning i kvantemekanik, kan løses for at opnå bølgefunktionen for et elektron i et atom.
* Bølgefunktionen beskriver sandsynligheden for at finde et elektron på et bestemt punkt i rummet.
* Virksomheden af bølgefunktionen (sandsynlighedstætheden) giver os formen på elektronskyen.
Vigtige noter:
* Formen på elektronskyen er en sandsynlighedsfordeling , hvilket betyder, at det viser sandsynligheden for at finde en elektron i en bestemt region i rummet.
* Elektronskyen er ikke et solidt objekt; Det er en region i rummet, hvor elektronet mest sandsynligt findes.
* Formen på elektronskyen er afgørende for at bestemme kemiske bindinger og reaktiviteten af atomer.
Sammenfattende bestemmes formen på en elektronsky af en kombination af kvantetal, som i sidste ende dikterer sandsynlighedsfordelingen af elektronet i rummet. Denne fordeling definerer det område, hvor elektronet mest sandsynligt findes, hvilket fører til de observerede former af atomiske orbitaler.
Sidste artikelDet punkt, hvor lette stråler mødes?
Næste artikelHvilken type nuklear reaktion finder sted i stjerner?
 Varme artikler
Varme artikler
-
 Privat kinesisk rumvirksomhed placerer satellitter i kredsløbKredit:CC0 Public Domain En raket udviklet af det kinesiske firma iSpace sprængte onsdag i rummet med tre miniaturesatellitter i endnu en milepæl for landets spirende private rumfartsindustri. Ra
Privat kinesisk rumvirksomhed placerer satellitter i kredsløbKredit:CC0 Public Domain En raket udviklet af det kinesiske firma iSpace sprængte onsdag i rummet med tre miniaturesatellitter i endnu en milepæl for landets spirende private rumfartsindustri. Ra -
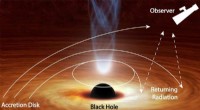 Sort hul bøjer lyset tilbage på sig selvDenne illustration viser, hvordan noget af lyset, der kommer fra en skive omkring et sort hul, bøjes tilbage på selve skiven på grund af det monstrøse sorte huls tyngdekraft. Lyset reflekteres derefte
Sort hul bøjer lyset tilbage på sig selvDenne illustration viser, hvordan noget af lyset, der kommer fra en skive omkring et sort hul, bøjes tilbage på selve skiven på grund af det monstrøse sorte huls tyngdekraft. Lyset reflekteres derefte -
 Nye ideer til, at mennesker kan overleve langt fra JordenKredit:istockphoto Hvordan kan vi bygge et levested på en isdækket planet? Det schweiziske rumcenter (SSC) har indgået et partnerskab med European Space Agency (ESA) for at forberede ESA_Lab@CH og
Nye ideer til, at mennesker kan overleve langt fra JordenKredit:istockphoto Hvordan kan vi bygge et levested på en isdækket planet? Det schweiziske rumcenter (SSC) har indgået et partnerskab med European Space Agency (ESA) for at forberede ESA_Lab@CH og -
 Skabte Apollo -missionerne opvarmning på månen?En astronauts fodaftryk i månens regolit, laget af fin grå jord, der dækker månens overflade. NASA Under missionerne Apollo 15 og Apollo 17 til månen i 1971 og 1972, astronauter borede huller i månen
Skabte Apollo -missionerne opvarmning på månen?En astronauts fodaftryk i månens regolit, laget af fin grå jord, der dækker månens overflade. NASA Under missionerne Apollo 15 og Apollo 17 til månen i 1971 og 1972, astronauter borede huller i månen
- Har New Horizons næste mål en måne?
- Forskere foreslår et nyt koncept for dannelse af terrestriske planeter
- Skyer dækker natsiden af den varme exoplanet WASP-43b
- Hvad er forklaringen af komponenter projektilbevægelse?
- Hvad sker der med dyrene i regnskoven, når det skæres ned?
- Er et sukkermolekyle større end salt, og hvorfor?


