Ulemperne ved Western Blotting
Western blotting er en af de mest almindelige procedurer i biokemiske laboratorier. I grund og grund adskiller det proteiner fra en prøve efter størrelse og testes derefter ved hjælp af antistoffer for at bestemme, om et givet protein er til stede. Det er nyttigt ikke kun i forskning, men også i medicinske eller diagnostiske laboratorier; test for både HIV og Lyme sygdom involverer for eksempel en enzymbundet immunosorbentassay (ELISA) test efterfulgt af en Western blot, hvis ELISA testes positivt. På trods af sin popularitet har Western blotting flere ulemper.
Ikke-kvantitative
Klassiske vestlige blots er ikke-kvantitative. Med andre ord, mens de kan fortælle forskerne om et bestemt protein er til stede, gør de ikke det muligt at kvantificere, hvor meget protein der er til stede. Nogle biotekvirksomheder sælger nu kits, der gør det muligt for forskere eller laboratorieteknikere at kvantificere mængden af protein til stede ved hjælp af en standardkurve - men det virker kun, hvis rene prøver af samme protein er tilgængelige. Desuden kan molekylvægten af et protein kun estimeres med Western blotting, snarere end bestemt præcist som med massespektrometri.
Antistoffer
En Western blot kan kun udføres, hvis primære antistoffer mod Protein af interesse er tilgængelige. Mens antistoffer til mange forskellige proteiner er tilgængelige fra biotekvirksomheder, er de ikke billige; Hvis primære antistoffer ikke er tilgængelige for et givet protein, vil det ikke være muligt at udføre et Western blot, der søger det pågældende protein. Desuden kan forskere måske bestemme, om et protein er blevet modificeret på en eller anden måde - hvis det er phosphoryleret (havde en phosphatgruppe knyttet til det) - og med Western blot-teknikken har de brug for antistoffer, der er specifikke for den modificerede protein.
Træning
Det kan være udfordrende at udføre en Western blot korrekt og få gode resultater, så personalet skal være veluddannet. I dette som i meget andet er erfaring måske den bedste vejleder; selv for en erfaren tekniker er en western blot tidskrævende. Gelelektroforese-delen af eksperimentet vil typisk tage fra en til to timer for at køre. Andre opgaver kan udføres, mens gelen kører, selvfølgelig, men eksperimentet tager stadig lang tid at få resultater.
Andre begrænsninger
Antistoffer kan nogle gange udvise nogle off-target bindinger, hvilket kan medføre dårligere resultater. Desuden bruger du med et Western blotting et antistof mod et specifikt protein, så dine resultater vil kun fortælle dig, om proteinet var til stede. Massespektrometri med høj opløsning afslører derimod alle proteiner, der er til stede i en prøve, og i modsætning til klassisk western blotting er det kvantitativt. Det er vigtigt at huske, at massespektrometri er meget dyrere og også mere teknisk udfordrende at bruge i forhold til Western blotting.
Sidste artikelAnvendelse af rekombinant DNA i landbruget
Næste artikelFordele og ulemper ved kloning af planter og dyr
 Varme artikler
Varme artikler
-
 Hvad er Marshmallow -testen, og kan dyr bestå den?Den originale skumfidustest undersøgte, om og hvordan børn distraherede sig selv for at undgå at spise en skumfidus i håb om at få to senere. doble.d/Getty Images Har du nogensinde set billeder af fø
Hvad er Marshmallow -testen, og kan dyr bestå den?Den originale skumfidustest undersøgte, om og hvordan børn distraherede sig selv for at undgå at spise en skumfidus i håb om at få to senere. doble.d/Getty Images Har du nogensinde set billeder af fø -
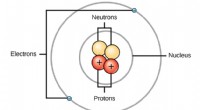 Bohr -modellen:hurtigt udskiftet, men aldrig glemtBohrs model af atomet. Wikimedia Commons (CC BY 4.0) Du kan søge efter et billede af et atom på internettet, og du finder et, selvom ingen faktisk har set et atom før. Men vi har et skøn over, hvorda
Bohr -modellen:hurtigt udskiftet, men aldrig glemtBohrs model af atomet. Wikimedia Commons (CC BY 4.0) Du kan søge efter et billede af et atom på internettet, og du finder et, selvom ingen faktisk har set et atom før. Men vi har et skøn over, hvorda -
 Hvad er lysets vej gennem øjet?Lysets sti gennem øjet begynder med de objekter, der ses, og hvordan de producerer, reflekterer eller ændrer lys på forskellige måder. Når dine øjne modtager lys, begynder det en anden rejse gennem øj
Hvad er lysets vej gennem øjet?Lysets sti gennem øjet begynder med de objekter, der ses, og hvordan de producerer, reflekterer eller ændrer lys på forskellige måder. Når dine øjne modtager lys, begynder det en anden rejse gennem øj -
 Udvikler den menneskelige hjerne stadig?Brain Image Gallery Hvordan ser vi ud i fremtiden? Se flere hjernebilleder. Spike Mafford/UpperCut Images/Getty Images Når vi dagdrømmer om fremtiden, vi har en tendens til at fokusere på de fantas
Udvikler den menneskelige hjerne stadig?Brain Image Gallery Hvordan ser vi ud i fremtiden? Se flere hjernebilleder. Spike Mafford/UpperCut Images/Getty Images Når vi dagdrømmer om fremtiden, vi har en tendens til at fokusere på de fantas


