Forskere udvider kraften i genredigering ved at udvikle en ny klasse af DNA-base-editorer
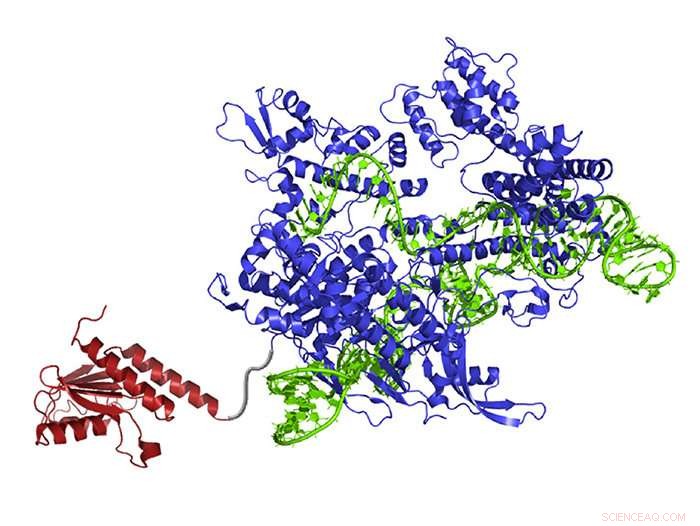
En nyoprettet DNA-base-editor indeholder et atom-omarrangerende enzym (rødt), der kan ændre adenin til inosin (læs og kopieres som guanin), guide RNA (grøn), som leder molekylet til det rigtige sted, og Cas9 nickase (blå), som klipper den modsatte streng af DNA og narre cellen til at bytte den komplementære base. Kredit:Gaudelli et al./ Natur 2017
Forskere ved Harvard University og Broad Institute of MIT og Harvard har udviklet en ny klasse af genomredigeringsværktøjer. Denne nye "base editor" kan direkte reparere den type enkeltbogstavsændringer i det menneskelige genom, der tegner sig for cirka halvdelen af humane sygdomsassocierede punktmutationer. Disse mutationer er forbundet med lidelser lige fra genetisk blindhed til seglcelleanæmi til metaboliske lidelser til cystisk fibrose.
Forskerholdet, ledet af David Liu, professor i kemi og kemisk biologi ved Harvard University, kerneinstitutmedlem ved Broad Institute, og en Howard Hughes Medical Institute (HHMI) efterforsker, udviklet en molekylær maskine, der kan omdanne DNA-baseparret A* T til G* C, uden at skære den dobbelte helix, med høj effektivitet og stort set ingen uønskede produkter. Udviklingen er en vigtig tilføjelse til den voksende suite af genomredigeringsværktøjer.
Det nye system er beskrevet i et papir offentliggjort i dag i Natur . Ud over Liu, undersøgelsen blev ledet af Nicole Gaudelli, en postdoc i Lius laboratorium; Alexis Komor, en tidligere postdoc-stipendiat i Lius laboratorium, som nu er adjunkt ved UCSD; kandidatstuderende Holly Rees; tidligere kandidatstuderende Michael Packer og Ahmed Badran, og tidligere postdoc-stipendiat David Bryson.
Det nye system, døbt Adenine Base Editor, eller ABE, kan programmeres til at målrette et specifikt basepar i et genom ved hjælp af et guide-RNA og en modificeret form af CRISPR-Cas9. Det virker ved at omarrangere atomerne i et mål adenin (A) - en af de fire baser, der udgør DNA - til i stedet at ligne guanin (G), og derefter narre celler til at fiksere den anden DNA-streng for at fuldføre baseparkonverteringen, gør ændringen permanent. Som resultat, hvad der plejede at være et A* T basepar bliver et G* C basepar.
Ikke alene er systemet meget effektivt sammenlignet med andre genomredigeringsteknikker til at korrigere punktmutationer, men der er stort set ingen påviselige biprodukter såsom tilfældige indsættelser, sletninger, translokationer, eller andre base-til-base-konverteringer.
Det er vigtigt at foretage denne specifikke ændring, fordi cirka halvdelen af de 32, 000 sygdomsassocierede punktmutationer, der allerede er identificeret af forskere, er en ændring fra G* C til A* T.
"Vi udviklede en ny basiseditor - en molekylær maskine - der i en programmerbar, irreversibel, effektiv, og ren måde kan korrigere disse mutationer i genomet af levende celler, " sagde Liu, som også er Richard Merkin-professor og direktør for Merkin Institute of Transformative Technologies in Healthcare på Broad. "Når den er målrettet mod bestemte steder i humant genomisk DNA, denne konvertering vender den mutation, der er forbundet med en bestemt sygdom."
ABE slutter sig til andre basisredigeringssystemer, der er banebrydende i Lius laboratorium, såsom BE3 og dens forbedrede variant, BE4. Ved at bruge disse basiseditorer, forskere kan nu korrigere alle de såkaldte "overgangs"-mutationer - C til T, T til C, A til G, eller G til A - der tilsammen tegner sig for næsten to tredjedele af alle sygdomsfremkaldende punktmutationer, herunder mange, der forårsager alvorlige sygdomme, som der ikke findes aktuel behandling for. Yderligere forskning er nødvendig, Liu bemærker, at gøre det muligt for ABE at målrette så meget af genomet som muligt, som Liu og hans elever tidligere opnåede gennem ingeniørvarianter af BE3.
Udviklingen af den nye baseeditor begyndte, da holdet begyndte en årelang indsats for at udvikle et nyt enzym, der kunne omdanne adenin til inosin (I), et nukleotid, der opfører sig på samme måde som G under DNA- eller RNA-syntese. Projektet, ledet af Gaudelli, resulterede i sidste ende i høj ydeevne, syvende generation af ABE'er.
"Den største udfordring for mig under udviklingen af ABE var at overvinde den psykologiske forhindring, om ABE kunne gå fra koncept til virkelighed eller ej, da nøglekomponenten i editoren ikke eksisterede naturligt og skulle udvikles i vores laboratorium, " sagde Gaudelli. "Det var vigtigt at bevare troen på, at vi ikke kun kunne drømme om sådan en molekylær maskine, men også bygge det."
For at demonstrere ABE's potentiale, Liu og kolleger brugte først ABE til direkte at korrigere en mutation, der forårsager arvelig hæmokromatose (HHC) i humane celler.
De brugte også ABE til at installere en mutation i menneskelige celler, der undertrykker en sygdom, genskabe den såkaldte "britiske mutation" fundet hos raske individer, som normalt ville udvikle blodsygdomme som seglcelleanæmi, men i stedet have en mutation, der får fosterets hæmoglobingener til at forblive aktive efter fødslen, beskytte dem mod blodsygdomme.
Mens udviklingen af ABE er et spændende skridt fremad inden for basisredigering, Der er mere arbejde tilbage, før basisredigering kan bruges til at behandle patienter med genetiske sygdomme, herunder test af sikkerhed, effektivitet, og bivirkninger.
"At skabe en maskine, der laver den genetiske ændring, du har brug for til at behandle en sygdom, er et vigtigt skridt fremad, men det er kun en del af det, der er nødvendigt for at behandle en patient, " sagde Liu. "Vi skal stadig levere den maskine, vi skal teste dens sikkerhed, vi er nødt til at vurdere dets gavnlige virkninger på dyr og patienter og veje dem mod eventuelle bivirkninger - vi er nødt til at gøre mange flere ting."
"Men at have maskinen er en god start."
 Varme artikler
Varme artikler
-
 Revolutionerende mikroskop og mærkningsteknik kortlægger DNA-mutationerEt typisk 3D-billede opsamlet af nanomapping-mikroskopet, der viser et CRISPR-mærket DNA-molekyle. Kredit:University of Bristol Et team af forskere, der arbejder ved University of Bristol, har udv
Revolutionerende mikroskop og mærkningsteknik kortlægger DNA-mutationerEt typisk 3D-billede opsamlet af nanomapping-mikroskopet, der viser et CRISPR-mærket DNA-molekyle. Kredit:University of Bristol Et team af forskere, der arbejder ved University of Bristol, har udv -
 Sådan laves en 3D-model til High School BiologyAt opbygge en model af en DNA-helix i klassen vil hjælpe eleverne med at visualisere DNAs konstruktion og lære om den livgivende genetiske kode. Ved hjælp af nogle enkle genstande som tandstikker, pla
Sådan laves en 3D-model til High School BiologyAt opbygge en model af en DNA-helix i klassen vil hjælpe eleverne med at visualisere DNAs konstruktion og lære om den livgivende genetiske kode. Ved hjælp af nogle enkle genstande som tandstikker, pla -
 Sådan bortskaffes Biohazard WasteBiohazard affald er medicinsk brugt papirkurven forurenet med blod eller andre infektiøse materialer. Autoklavering af disse elementer er den normalt udførte proces. Sharps (nåle, sprøjter eller ligne
Sådan bortskaffes Biohazard WasteBiohazard affald er medicinsk brugt papirkurven forurenet med blod eller andre infektiøse materialer. Autoklavering af disse elementer er den normalt udførte proces. Sharps (nåle, sprøjter eller ligne -
 Team udvikler genkredsløbsdesignstrategi for at fremme syntetisk biologiKreds-vært-interaktioner og deres konsekvenser på tværs af skalaer. Syntetiske kredsløb og værten danner en dynamisk, flerlagsforhold, der involverer både generiske og systemspecifikke interaktioner,
Team udvikler genkredsløbsdesignstrategi for at fremme syntetisk biologiKreds-vært-interaktioner og deres konsekvenser på tværs af skalaer. Syntetiske kredsløb og værten danner en dynamisk, flerlagsforhold, der involverer både generiske og systemspecifikke interaktioner,
- Facebook udruller privatlivsvalg under EU-regler
- Efterårshedebølge bringer Californien mere brandfare
- Hvad gør Kina for at skabe et grønt OL?
- Niger Delta:Unge mænd står over for udstødelse og vold på et af de mest forurenede steder på Jo…
- Indiske astronomer undersøger den åbne klynge Czernik 3
- Ny forskning udvikler spintronics -teknologien


