Uventet fund løser 40 år gammelt cytoskelet-mysterium
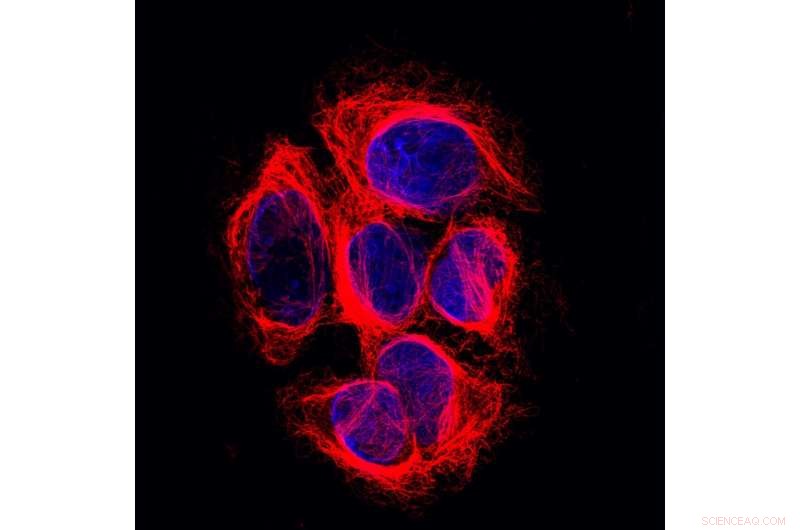
Seks melanomceller. Deres DNA (blåt) findes i cellekernen, deres mikrotubuli (røde) i cytoplasmaet, omkring kernen. Kredit:Netherlands Cancer Institute
Forskere har ledt efter det i årtier:enzymet, der skærer aminosyren tyrosin fra en vigtig del af cellens skelet. Forskere fra det hollandske kræftinstitut har nu identificeret denne mystiske spiller, som kan være af afgørende betydning for forståelsen af cellefunktion og deling, og derfor forståelsen af kræft. Resultaterne offentliggøres i Videnskab .
Ligesom den menneskelige krop som helhed, hver menneskelig celle har et skelet, den skal bruge for at fungere korrekt. Det såkaldte cytoskelet tillader en celle at bevare sin form, flytte til forskellige steder og transportere molekyler gennem dets indre. Lange kæder kaldet mikrotubuli udgør en vigtig del af det skelet og fungerer som en motorvej til transport af molekyler. For eksempel, mikrotubuli spiller en nøglerolle i celledeling ved at lade cellen nøje justere deres kromosomer, før de deler dem mellem datterceller. Deres afgørende betydning for cellen er let illustreret af arbejdsmekanismen i en meget anvendt gruppe af kræftlægemidler kaldet taxaner:de forstyrrer mikrotubulus funktion og dræber derved delende celler.
Mystisk spiller
Det er blevet foreslået, at korrekt transport på dette afgørende tidspunkt i cellecyklussen involverer detyrosinering, hvor aminosyren tyrosin fjernes fra halen af en af mikrotubuliernes hovedbyggesten:α-tubulin. I løbet af de sidste fire årtier har forskere ledt efter hovedaktøren i denne proces. På trods af dets betydning for flere cellulære processer forblev det ukendt, hvilket enzym der fjerner tyrosinen.
Forskere fra det hollandske kræftinstitut har nu løst dette puslespil ved at afsløre mysteriespilleren. Ved at bruge deres nyligt udviklede innovative genetiske screeningsmetode identificerede Joppe Nieuwenhuis og hans kolleger det lille SVBP-protein som værende en afgørende del af processen. Dette lille protein binder – og stabiliserer derved – proteiner kaldet vasohibiner, som synes at have tubulin-detyrosineringsaktivitet. Nieuwenhuis:"Disse resultater er overraskende, fordi vasohibiner blev antaget at fungere uden for cellen, og først for nylig blev det forudsagt, at disse proteiner kunne fungere som enzymer, uden at kende deres funktion."
Hårdt puslespil
Hvordan fandt Nieuwenhuis og hans kolleger på Thijn Brummelkamps laboratorium disse molekylære nøglespillere? Ved at bruge genom brede tilfældige mutationer i humane celler, der kun indeholder en kopi af hvert gen. Efterfølgende udvalgte de de celler, hvori den undersøgte detyrosineringsproces blev brudt på grund af en af de tilfældigt indførte mutationer. Ved at selektere cellerne med meget lidt detyrosineret tubulin opdagede de, at disse celler havde et muteret (og derfor dysfunktionelt) SVBP-gen. Yderligere eksperimenter bekræftede interaktionen med vasohibiner og dens virkning på tubulin-detyrosinering.
"For cellebiologer kunne dette være et vigtigt skridt", siger Nieuwenhuis. "Vi har fundet en brik i puslespillet, som videnskabsmænd har stirret på i mange år, fordi processen med detyrosinering blev opdaget for 40 år siden. Denne viden kunne være relevant for yderligere at forstå mitoseprocesserne, cellemigration og kræftudvikling. Det er allerede fundet, at den invasive front i nogle tumorvæv, hvor celler migrerer mest aktivt, indeholder en høj mængde detyrosineret tubulin. Det er interessant at spekulere i, at hæmning af detyrosinering kan være gavnligt under visse forhold."
Interessant nok, i samme udgave af Science nåede en gruppe franske videnskabsmænd frem til lignende konklusioner ved hjælp af en biokemisk tilgang til at identificere detyrosinerende enzymer.
Sidste artikelDisse ringhale-lemurer stinker, når de flirter med potentielle kammerater
Næste artikelLivets forbløffende effektivitet
 Varme artikler
Varme artikler
-
 Hvad betyder ##### i Excel?Excel-regneark viser en række tal- eller pundskilte som ##### i en celle, når kolonnen ikke er stor nok til at få vist oplysningerne. Det sker også, hvis du har en celle formateret til at vise noget a
Hvad betyder ##### i Excel?Excel-regneark viser en række tal- eller pundskilte som ##### i en celle, når kolonnen ikke er stor nok til at få vist oplysningerne. Det sker også, hvis du har en celle formateret til at vise noget a -
 Er alger en dekomponator, en fjerning eller en producent?Alger er ikke planter, dyr eller svampe. De hører til Kingdom Protista, en forskelligartet gruppe af encellede eukaryoter. Protister har deres eget rige, fordi mange arter deler nogle kendetegn ved
Er alger en dekomponator, en fjerning eller en producent?Alger er ikke planter, dyr eller svampe. De hører til Kingdom Protista, en forskelligartet gruppe af encellede eukaryoter. Protister har deres eget rige, fordi mange arter deler nogle kendetegn ved -
 Høje priser på animalske produkter er en del af en ond cirkel mod udryddelseEn afrikansk elefant i Tanzania ... udryddelsesprocessen begynder tidligere, end videnskabsmænd tidligere har forstået. Kredit:Wikipedia Commons Skyhøjende priser for sjældne animalske produkter k
Høje priser på animalske produkter er en del af en ond cirkel mod udryddelseEn afrikansk elefant i Tanzania ... udryddelsesprocessen begynder tidligere, end videnskabsmænd tidligere har forstået. Kredit:Wikipedia Commons Skyhøjende priser for sjældne animalske produkter k -
 Lovene om tiltrækning:Bestøverne bruger flere tegn til at identificere blomster på tværs af kont…Hoverfly bestøverne besøgte smørblomster i Thangu Valley, North Sikkim, et af de valgte kontinentale steder. Kredit:Shannon Olsson Selvom mindst 75% af vores afgrødearter er afhængige af vilde bes
Lovene om tiltrækning:Bestøverne bruger flere tegn til at identificere blomster på tværs af kont…Hoverfly bestøverne besøgte smørblomster i Thangu Valley, North Sikkim, et af de valgte kontinentale steder. Kredit:Shannon Olsson Selvom mindst 75% af vores afgrødearter er afhængige af vilde bes
- Forskere opdager, at tung elementkemi kan ændre sig ved højt tryk
- Frankrig idømmer Apple en bøde på 1,2 milliarder dollar for konkurrencebegrænsende handlinger
- Med malede ansigter, kunstnere kæmper mod ansigtsgenkendelsesteknologi
- Chemist syntetiserer nye forbindelser med stærke antidiabetiske egenskaber
- Virkningerne af jord erosion
- Ether kryptovaluta, et offer for blockchain-succes


