Lyser på bakteriel celledeling
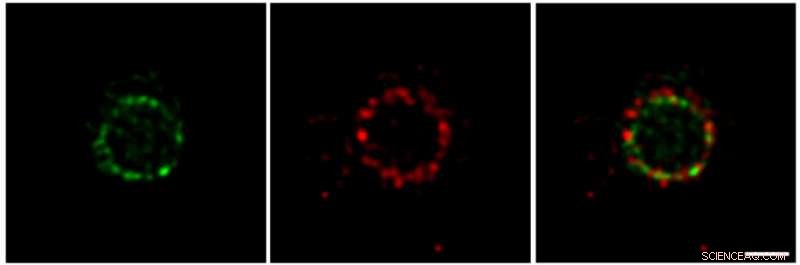
Nanoskopiske billeder, der viser den rumlige organisering af to celledelingsproteiner i E. coli-celler. FtsZ (grøn) og FtsN (rød) er organiseret i plettede ringe på delingsstedet. Kredit:Okinawa Institute of Science and Technology
Forestil dig at prøve at besejre en hær af angribere, der kan fordoble sin befolkningsstørrelse hvert tyvende minut. Det er det, den menneskelige krop står over for, når den bliver inficeret med en skadelig stamme af Escherichia coli (E. coli), en type bakterier, der kan formere sig hurtigt og forårsage en lang række ubehagelige og potentielt farlige sygdomme, såsom diarré, luftvejssygdomme og lungebetændelse.
Med den verdensomspændende stigning i antibiotikaresistens, forskere søger desperat nye måder at bekæmpe bakterielle infektioner med medicin. En effektiv metode til at forhindre bakterieceller i at dele sig og formere sig ville være at målrette celledelingsmaskineriet. Imidlertid, for at opnå dette, et mere detaljeret billede af selve maskineriets struktur og organisering er påkrævet.
Forskere fra Structural Cellular Biology Unit ved Okinawa Institute of Science and Technology Graduate University (OIST), i samarbejde med forskere fra Stockholms Universitet, har kastet lys over mekanismen for celledeling i E. coli. Deres forskning blev for nylig offentliggjort i Molekylær mikrobiologi .
I det lange løb, denne forskning kan hjælpe med at identificere nye måder at målrette bakterier på med antibiotika. "Hvis vi kan forstå de mekanismer, hvorved bakterieceller deler sig mere detaljeret, så kan vi forsøge at skabe stoffer, der forstyrrer disse mekanismer, " siger Bill Söderström, hovedforfatter af papiret.
De fleste bakterieceller replikerer ved binær fission, en proces, hvor modercellen trækker sig sammen og adskilles i to identiske datterceller. Under celledeling, en stor molekylær maskine kaldet 'divisomet' samles inde i cellen. Forskerne har afsløret den rumlige organisering af to nøgleproteiner fra E. coli divisome, 'FtsZ' og 'FtsN'.
I lang tid, cellebiologer havde antaget, at alle proteiner i divisomet var klynget sammen i et stort superkompleks. Konventionel fluorescensmikroskopi har relativt lav opløsningsevne, hvilket betyder, at tilstødende objekter, der er meget tæt på hinanden, nogle gange fremstår som en enkelt enhed. Imidlertid, ved at bruge en banebrydende billedbehandlingsteknik tilgængelig på OIST kaldet super-resolution Stimulated Emission Depletion (STED) nanoskopi, forskerne var i stand til at visualisere divisionsmaskineriet på nanoskala. "Med bedre opløsning, vi var i stand til at se forskellen mellem de to proteinringe og udlede detaljer om processen med celledeling, siger Söderström.
Brug af to fluorescerende farver til at mærke FtsZ og FtsN i henholdsvis grøn og rød, forskerne afslørede, at begge proteiner er lokaliseret i store samlinger, som er fordelt ujævnt rundt på delingsstedet. Tidligt i opdelingsprocessen, de to proteiner danner ikke-overlappende pletformede ringe. Efterhånden som celledelingen skrider frem, den grønne ring, dannet af FtsZ, bevæger sig inde i den røde ring, dannet af FtsN. Konstateringen af, at disse proteiner ikke altid overlapper hinanden, men er opdelt i flere grupper, tyder på, at divisomet ikke fungerer som en enkelt molekylær maskine. Hellere, hver proteingruppe spiller en bestemt rolle.
Med et mere detaljeret billede af celledelingsmaskineriet, biologer kan designe nye antibiotika for at forhindre bakterieceller i at dele sig og formere sig. "Det næste skridt er at se på mange flere par af celledelingsproteiner og finde ud af, hvilke af disse vi skal målrette mod med lægemidler, siger Söderström.
 Varme artikler
Varme artikler
-
 DNA er blevet digitalt - hvad kan gå galt?Moderne fremskridt kommer med nye forpligtelser. Kredit:Sergey Nivens/Shutterstock.com Biologien bliver mere og mere digitaliseret. Forskere som os bruger computere til at analysere DNA, betjene l
DNA er blevet digitalt - hvad kan gå galt?Moderne fremskridt kommer med nye forpligtelser. Kredit:Sergey Nivens/Shutterstock.com Biologien bliver mere og mere digitaliseret. Forskere som os bruger computere til at analysere DNA, betjene l -
 Sådan bygger du en 3D-model af en plantecelleBygning af en 3D-model af en plantecelle er en passage for studerende. Ikke kun er dette projekt en informativ måde at lære om plantecellers struktur, det er også en mulighed for at flexere din fantas
Sådan bygger du en 3D-model af en plantecelleBygning af en 3D-model af en plantecelle er en passage for studerende. Ikke kun er dette projekt en informativ måde at lære om plantecellers struktur, det er også en mulighed for at flexere din fantas -
 Forskere afslører en ny vej til at undertrykke virus-inducerede kræftformerDr Sudhakar Jha, Principal Investigator ved Cancer Science Institute of Singapore (til højre) og Deepa Rajagopalan, Ph.d.-studerende ved NUS (venstre), identificeret en ny molekylær vej, hvorved en tu
Forskere afslører en ny vej til at undertrykke virus-inducerede kræftformerDr Sudhakar Jha, Principal Investigator ved Cancer Science Institute of Singapore (til højre) og Deepa Rajagopalan, Ph.d.-studerende ved NUS (venstre), identificeret en ny molekylær vej, hvorved en tu -
 Myg er mere tilbøjelige til at overføre dengue-virus i varmt vejrEt TEM-mikrografi, der viser dengue-virusvirioner (klyngen af mørke prikker nær midten). Billede:CDC Dengue-virus vokser og spreder sig hurtigere i myg ved højere temperaturer, men går langsomme
Myg er mere tilbøjelige til at overføre dengue-virus i varmt vejrEt TEM-mikrografi, der viser dengue-virusvirioner (klyngen af mørke prikker nær midten). Billede:CDC Dengue-virus vokser og spreder sig hurtigere i myg ved højere temperaturer, men går langsomme
- Billede:Stort kikkertteleskop får det første glimt af NASAs OSIRIS-REx-rumfartøj siden opsendelse…
- Seneste lockdown havde mindre indvirkning på britiske luftforureningsniveauer end det første, ny a…
- Foreslået metode til at få et atom til at udsende det samme lys som et andet atom
- Undersøgelse viser, at Thwaites Glaciers istab muligvis ikke udvikler sig så hurtigt, som man troe…
- Nye materialer til at hjælpe med at stoppe lithium-ion-batteri, eksplosioner og forbedrer batteriet…
- Sådan lærer du matematik med Cuisenaire Rods


