Hvordan et protein løsner sig og forårsager dødelige kræftformer
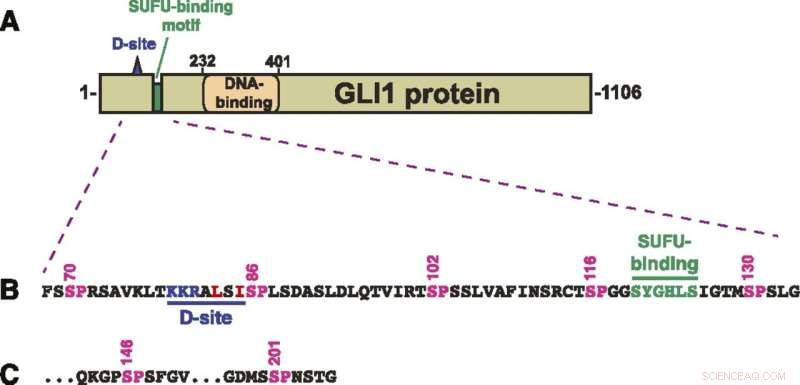
Struktur af GLI1 protein. (A) Skematisk over den primære struktur af humant GLI1-protein, der viser MAPK-dockingstedet (D-stedet), det SUFU-bindende motiv og det zinkfinger-DNA-bindende domæne. Det transkriptionelle aktiveringsdomæne udgør en stor del af den C-terminale halvdel af proteinet. (B) Aminosyresekvens af rester 68-134, der viser D-stedet, det SUFU-bindende motiv og en klynge af fem kanoniske MAPK-phosphoryleringssteder (SP). Tallene ovenfor viser positionen af serinresterne i SP-stederne. (C) De sidste to af de syv SP MAPK-phosphoryleringssteder indeholdt i rester af 68-232 GLI1. Efter S201 opstår det næste SP- eller TP-sted ved S441. Kredit:A. Jane Bardwell et al., Life Science Alliance (2022). DOI:10.26508/lsa.202101353
Bedre behandlinger for nogle af kræftens mest dødelige former kunne være tættere på på grund af en opdagelse ledet af University of California, Irvine om, hvordan et bestemt protein aktiveres i tumorceller. Fundet, ledet af forskere fra School of Biological Sciences, kan i sidste ende føre til mulige behandlingsformer for det særligt farlige melanom og bugspytkirtel-adenokarcinom, såvel som den mest almindelige form for hjernekræft i barndommen og hudkræft hos voksne. Et papir, der beskriver projektet, vises i Life Science Alliance .
Opdagelsen vedrører GLI1-proteinet, som er vigtigt i celleudviklingen, men som også er blevet fundet tændt i forskellige kræftformer. GLI1 aktiveres typisk af Hedgehog-signalvejen, kendt som HH. Forskere har dog i omkring et årti vidst, at krydstale (interaktion) mellem HH og den mitogen-aktiverede proteinkinase-vej har en rolle i cancer.
"I nogle tilfælde kan proteiner i én vej tænde proteiner i en anden," sagde hovedforfatter A. Jane Bardwell, projektforsker i UCI's afdeling for udviklings- og cellebiologi. "Det er et komplekst system. Vi ønskede at forstå den molekylære mekanisme, der fører til, at GLI1 aktiveres af proteiner i MAPK-vejen."
GLI1 binder normalt tæt til et protein kaldet SUFU. Det protein undertrykker GLI1 og forhindrer det i at trænge ind i cellekerner og tænde for gener. Forskerne undersøgte syv steder på GLI1-proteinet, der kunne phosphoryleres eller have en phosphatgruppe overført til det.
"Vi har identificeret tre, der kan phosphoryleres og er involveret i at svække bindingen mellem GLI1 og SUFU," sagde Lee Bardwell, professor i udviklings- og cellebiologi, hvis laboratorium udførte projektet. "Denne proces aktiverer GLI1, hvilket gør den i stand til at komme ind i cellekernen, hvor den kan forårsage ukontrolleret vækst, hvilket resulterer i kræft."
Han bemærkede, at phosphorylering af alle tre steder forårsager et betydeligt højere niveau af GLI1-udslip fra SUFU, end hvis blot én eller endda to af dem modtager fosfatgrupper.
Opdagelsen er et væsentligt skridt mod mere effektive og personlige kræftbehandlinger. "Hvis vi kan forstå præcis, hvad der foregår i en bestemt kræft eller en bestemt tumor, kan det være muligt at udvikle et lægemiddel, der er specifikt for en specifik tumor eller individuel patient," sagde Bardwell. "Det ville give os mulighed for at behandle disse sygdomme uden toksiciteten af grundlæggende kemoterapi." Derudover har mange tumorer fra den samme cancer forskellige mutationer blandt individer. Til sidst kan det være muligt at screene tumorer for at udvikle den bedste tilgang til hver enkelt.
Forskningen blev udført i samarbejde med UCI School of Medicine's Department of Microbiology &Molecular Genetics og Stanford University School of Medicines Department of Dermatology.
Sidste artikelHvornår opstod genetiske variationer, der gør os til mennesker?
Næste artikelGav gonoré os bedsteforældre?
 Varme artikler
Varme artikler
-
 Er dumme mennesker gladere?Uvidenhed er ikke altid lyksalighed. © iStockphoto.com/EyeJoy Som det gamle ordsprog siger, uvidenhed er lyksalighed. Tænke, for eksempel, om ofrene for Bernie Madoffs berygtede Ponzi -ordning. Du
Er dumme mennesker gladere?Uvidenhed er ikke altid lyksalighed. © iStockphoto.com/EyeJoy Som det gamle ordsprog siger, uvidenhed er lyksalighed. Tænke, for eksempel, om ofrene for Bernie Madoffs berygtede Ponzi -ordning. Du -
 Ormens genomer afslører en forbindelse mellem mennesker og fjerne slægtningeEn nemertean orm ( Notospermus geniculatus ). Til venstre:en sammentrukket orm. Til højre:en forlænget orm. Den nemerteiske krop er sædvanligvis meget sammentrækbar og kan forlænges. Nogle nemertear
Ormens genomer afslører en forbindelse mellem mennesker og fjerne slægtningeEn nemertean orm ( Notospermus geniculatus ). Til venstre:en sammentrukket orm. Til højre:en forlænget orm. Den nemerteiske krop er sædvanligvis meget sammentrækbar og kan forlænges. Nogle nemertear -
 Forstå sproget i mobilkommunikationI flercellede organismer, celler skal adressere beskeder til specifikke andre celletyper. For at gøre det, celler bruger et sæt lignende, men ikke identisk, signalerende proteiner, eller ligander. Hve
Forstå sproget i mobilkommunikationI flercellede organismer, celler skal adressere beskeder til specifikke andre celletyper. For at gøre det, celler bruger et sæt lignende, men ikke identisk, signalerende proteiner, eller ligander. Hve -
 Hvorfor opretstående pingviner afviser deres første æg og lægger et andetOpretstående pingviner er kendetegnet ved de slående opretstående toppe af gule fjer over deres øjne. Kredit:Lloyd Davis Photography (lloyddavis.com), CC-BY 4.0 (creativecommons.org/licenses/by/4.0/)
Hvorfor opretstående pingviner afviser deres første æg og lægger et andetOpretstående pingviner er kendetegnet ved de slående opretstående toppe af gule fjer over deres øjne. Kredit:Lloyd Davis Photography (lloyddavis.com), CC-BY 4.0 (creativecommons.org/licenses/by/4.0/)
- Ny undersøgelse sporer Ios vulkanske tidevand
- Chiral-inducerede, selvlysende ultratynde kovalente organiske ramme-nanoark
- Økologiteam finder, at bladaffald har en langsommere nedbrydningshastighed i varme temperaturer
- Amerikanske embedsmænd beordrer kinesisk virksomhed til at sælge Grindr:rapport
- Cassini forbereder sig på ringgræsningskredsløb
- Ingeniører gør klare dråber producerer iriserende farver


