Gav gonoré os bedsteforældre?
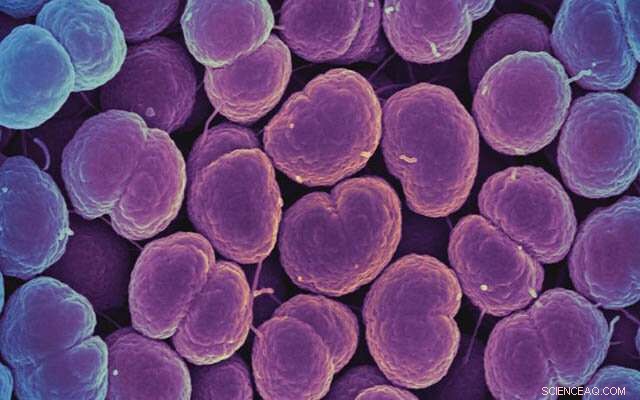
Neisseria gonorrhoeae-bakterier kan have drevet udviklingen af menneskelige genvarianter, der beskytter mod demens. Kredit:National Institute of Allergy and Infectious Diseases, National Institutes of Health
Forskere ved University of California San Diego School of Medicine har tidligere fundet et sæt humane genmutationer, der beskytter ældre voksne mod kognitiv tilbagegang og demens. I en ny undersøgelse, offentliggjort 9. juli 2022 i Molecular Biology and Evolution , fokuserer de på et af disse muterede gener og forsøger at spore dets udvikling - hvornår og hvorfor det dukkede op i det menneskelige genom. Resultaterne tyder på, at selektivt pres fra infektiøse patogener som gonoré kan have fremmet fremkomsten af denne genvariant i Homo sapiens og utilsigtet understøttet eksistensen af bedsteforældre i det menneskelige samfund.
De fleste dyrearters biologi er optimeret til reproduktion, ofte på bekostning af fremtidigt helbred og længere levetid. Faktisk er mennesker en af de eneste arter, der vides at leve langt forbi overgangsalderen. Ifølge "bedstemor-hypotesen" skyldes det, at ældre kvinder yder vigtig støtte til at opdrage menneskelige spædbørn og børn, som kræver mere pleje end ungerne af andre arter. Forskere forsøger nu at forstå, hvilke træk ved menneskelig biologi der gør dette langsigtede helbred muligt.
Da forskere tidligere sammenlignede menneske- og chimpansegenomer, fandt de ud af, at mennesker har en unik version af genet for CD33, en receptor udtrykt i immunceller. Standard CD33-receptoren binder sig til en type sukker kaldet sialinsyre, som alle menneskelige celler er belagt med. Når immuncellen fornemmer sialinsyren via CD33, genkender den den anden celle som en del af kroppen og angriber den ikke, hvilket forhindrer en autoimmun reaktion.
CD33-receptoren udtrykkes også i hjernens immunceller kaldet mikroglia, hvor den hjælper med at kontrollere neuroinflammation. Imidlertid spiller mikroglia også en vigtig rolle i at fjerne beskadigede hjerneceller og amyloide plaques forbundet med Alzheimers sygdom. Ved at binde sig til sialinsyrerne på disse celler og plaques undertrykker almindelige CD33-receptorer faktisk denne vigtige mikrogliale funktion og øger risikoen for demens.
Det er her, den nye genvariant kommer ind. Et eller andet sted langs den evolutionære linje optog mennesker en yderligere muteret form af CD33, der mangler sukkerbindingsstedet. Den muterede receptor reagerer ikke længere på sialinsyrer på beskadigede celler og plaques, hvilket tillader mikroglia at nedbryde dem. Faktisk blev højere niveauer af denne CD33-variant uafhængigt fundet at være beskyttende mod sent-debuterende Alzheimers.
I et forsøg på at forstå, hvornår denne genvariant først dukkede op, fandt co-seniorforfatter Ajit Varki, MD, Distinguished Professor of Medicine og Cellular and Molecular Medicine ved UC San Diego School of Medicine, og kolleger beviser på stærk positiv selektion, hvilket tyder på, at noget var drivende genet til at udvikle sig hurtigere end forventet. De opdagede også, at denne særlige version af CD33 ikke var til stede i genomerne af neandertalere eller denisovaner, vores nærmeste evolutionære slægtninge.
"For de fleste gener, der er forskellige hos mennesker og chimpanser, har neandertalere normalt den samme version som mennesker, så dette var virkelig overraskende for os," sagde Varki. "Disse resultater tyder på, at sunde bedsteforældres visdom og omsorg kan have været en vigtig evolutionær fordel, som vi havde i forhold til andre gamle homininarter."
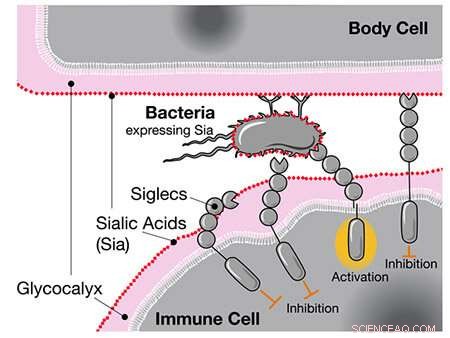
Når Siglecs som CD33 fornemmer humane sialinsyrer, hæmmer de immuncellens respons, selvom disse syrer er placeret på bakterier. Kredit:UC San Diego Health Sciences
Varki ledede undersøgelsen med Pascal Gagneux, Ph.D., professor i patologi ved UC San Diego School of Medicine og professor i Institut for Antropologi. Forfatterne sagde, at undersøgelsen giver nye beviser, der understøtter bedstemor-hypotesen.
Alligevel siger evolutionsteorien, at reproduktiv succes er den vigtigste drivkraft for genetisk selektion, ikke post-reproduktiv kognitiv sundhed. Så hvad var det, der pressede udbredelsen af denne muterede form af CD33 hos mennesker?
En mulighed, foreslår forfatterne, er, at meget smitsomme sygdomme som gonoré, som kan være skadelige for reproduktiv sundhed, kan have påvirket menneskets evolution. Gonorébakterier dækker sig selv med de samme sukkerarter, som CD33-receptorer binder til. Som en ulv i fåretøj er bakterierne i stand til at narre menneskelige immunceller til ikke at identificere dem som angribere udefra.
Forskerne foreslår, at den muterede version af CD33 uden et sukkerbindingssted opstod som en menneskelig tilpasning mod en sådan "molekylær mimik" af gonoré og andre patogener. Faktisk bekræftede de, at en af de menneskespecifikke mutationer var i stand til fuldstændig at ophæve interaktionen mellem bakterierne og CD33, hvilket ville gøre det muligt for immunceller at angribe bakterierne igen.
Alt i alt mener forfatterne, at mennesker oprindeligt arvede den muterede form af CD33 for at beskytte mod gonoré i den reproduktive alder, og denne genvariant blev senere co-opteret af hjernen for dens fordele mod demens.
"Det er muligt, at CD33 er et af mange gener, der er udvalgt for deres overlevelsesfordele mod infektiøse patogener tidligt i livet, men som så sekundært selekteres for deres beskyttende virkning mod demens og andre aldringsrelaterede sygdomme," sagde Gagneux.
Medforfattere inkluderer Sudeshna Saha, Naazneen Khan, Andrea Verhagen, Aniruddha Sasmal og Sandra Diaz ved UC San Diego; Troy Comi og Joshua M. Akey ved Princeton University; Hai Yu og Xi Chen ved UC Davis, og Martin Frank hos Biognos AB.
 Varme artikler
Varme artikler
-
 Flagermus og insekter kæmper i tropernePanamas katydider kommer i alle størrelser, viser ekstremerne af artsdiversitet. Kredit:Sharon Martinson i de tropiske regnskove i Panama, Dartmouths Hannah ter Hofstede er vidne til, hvad Charles
Flagermus og insekter kæmper i tropernePanamas katydider kommer i alle størrelser, viser ekstremerne af artsdiversitet. Kredit:Sharon Martinson i de tropiske regnskove i Panama, Dartmouths Hannah ter Hofstede er vidne til, hvad Charles -
 I en varmere verden er halvdelen af alle arter på vej. Hvor skal de hen?Output tidskort fra createTimeMaps()-funktionen i megaSDM, der beskriver rækkeviddeskift for Franklins jordegern Poliocitellus franklinii på tværs af to forskellige klimascenarier (henholdsvis RCP4.5
I en varmere verden er halvdelen af alle arter på vej. Hvor skal de hen?Output tidskort fra createTimeMaps()-funktionen i megaSDM, der beskriver rækkeviddeskift for Franklins jordegern Poliocitellus franklinii på tværs af to forskellige klimascenarier (henholdsvis RCP4.5 -
 Kemikalier, der bruges i retsmedicinsk videnskabRetsmedicinsk videnskab bruger teknologisk og kemi til at indsamle og analysere bevis for forbrydelser. Feltet inkluderer opgaver såsom indsamling af fingeraftryk eller testning af kemikalier i blod o
Kemikalier, der bruges i retsmedicinsk videnskabRetsmedicinsk videnskab bruger teknologisk og kemi til at indsamle og analysere bevis for forbrydelser. Feltet inkluderer opgaver såsom indsamling af fingeraftryk eller testning af kemikalier i blod o -
 Din krops celler bruger og modstår kraft, og de bevæger sig. Dens mekanobiologiVi kan bruge mekanobiologi til at lære, hvordan immunceller angriber kræftceller. Kredit:www.shutterstock.com Mekaniske kræfter styrer biologiske processer, fra sammentrækningerne af det pumpelign
Din krops celler bruger og modstår kraft, og de bevæger sig. Dens mekanobiologiVi kan bruge mekanobiologi til at lære, hvordan immunceller angriber kræftceller. Kredit:www.shutterstock.com Mekaniske kræfter styrer biologiske processer, fra sammentrækningerne af det pumpelign
- Traditionel eutektisk legering bringer nyt håb til metal-oxygenbatterier med høj energi densitet
- Hvordan australske supercomputere knuste tallene for at guide vores bushbrand og pandemiske reaktion
- En grøn øl, der ligner alger? Det hele er til rent vand
- Forskere udforsker mysterier bag mangfoldigheden af DNA-sammensætning blandt arter
- Marketing har store fordele for iværksættere på nye markeder, undersøgelse viser
- I EU, 1 ud af 8 dødsfald i forbindelse med forurening:rapport


