Din krops celler bruger og modstår kraft, og de bevæger sig. Dens mekanobiologi
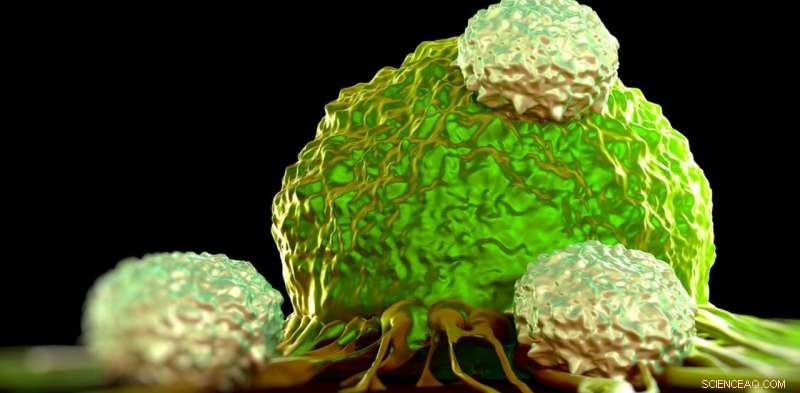
Vi kan bruge mekanobiologi til at lære, hvordan immunceller angriber kræftceller. Kredit:www.shutterstock.com
Mekaniske kræfter styrer biologiske processer, fra sammentrækningerne af det pumpelignende hjerte, til muskler, der ligner strenge og trisser, og celler, der udfører mikroskopiske tovtrækninger.
Tidligere, disse mekaniske aspekter af biologi er stort set blevet ignoreret, ikke mindst på grund af manglende teknologi, der giver mulighed for komplicerede mekaniske målinger.
Men der udvikles bedre værktøjer, og disse muliggør sporing af mekanisk aktivitet i celler og væv.
Og på grund af denne synlighed, nye lægemidler og behandlinger begynder at dukke op.
Mekanobiologi er videnskaben om, hvordan celler og væv sanser og reagerer på mekaniske kræfter.
Ligesom vi mennesker har muskler og knogler, der giver os evnen til at udøve kræfter, hver af vores celler har også et skelet:cytoskelettet. Dette netværk af fibre tillader celler at udøve og modstå kræfter, og sætter dem i stand til at bevæge sig.
Ser T-celler
T-celler er en del af vores immunsystem:de kan fungere som cellulære snigmordere, dræbe andre celler, såsom dem, der er inficeret med virus, eller kræftceller.
På mikroskala (ca. en hundrededel af et menneskehår), vi kan visualisere og følge T-celler på jagt efter kræftceller, når de bevæger sig og skubber sig vej gennem væv. Dette gælder fremgangsmåden kendt som 3-D traction force microscopy (TFM).
Efter at have fundet en kræftcelle, en T-celle griber fast sit mål, og giver et "dødskys".
Teknikker kendt som dobbelt pipetteaspiration (DPA) og optisk pincet (se video nedenfor) giver os mulighed for at gribe individuelle celler, og parre dem sammen på en kontrolleret måde. Dette giver os mulighed for at forstå og illustrere mekanikken bag dette dødbringende "kys".
Ved at bruge mekanobiologiske teknikker til at se, hvordan T-celler finder og dræber kræftceller, kan muliggøre bedre målretning af anti-cancer immunterapier.
Den første immunterapi rettet mod kræft ved hjælp af en patients egne T-celler blev for nylig godkendt af USAs Food and Drug Administration (FDA).
Fornemmer kraften
Celler bruger kraftsensorer til at detektere og skelne mellem mange af de fysiske signaler, de oplever.
En hovedklasse af kraftsensorer er "mekanofølsomme ionkanaler". Det er huller, eller porer, i cellens overflade, der kan åbne og lukke.
Når cellen fornemmer en fysisk kraft eller en mekanisk stimulus (i det væsentlige, som en mikroskopisk prod), disse porer kan åbne sig. Kemikalier bevæger sig ind og ud, og en lillebitte elektrisk strøm ledes hen over cellevæggen. Dette kan måles ved at fastgøre små elektroder til overfladen af en celle.
Mange typer celler og væv har sådanne sensorer, og reagere på ændringer i mekaniske belastninger. Disse inkluderer neuroner, der understøtter vores følesans, metastaserende kræftceller og de celler, der holder vores brusk i knoglerne.
Lægemidlet EVENITY – som har til formål at forhindre knogletab ved osteoporose – virker gennem denne vej. Lægemidlet blokerer sklerostin, en nøglefaktor, der naturligt hæmmer knogledannelsen baseret på de knogledannende cellers mekanosenserende funktioner.
Forsøgt i mus, der rejser til den internationale rumstation, behandlingen har nu bestået humane kliniske forsøg og afventer FDA-godkendelse til brug i behandlingen af osteoporotiske patienter i USA.
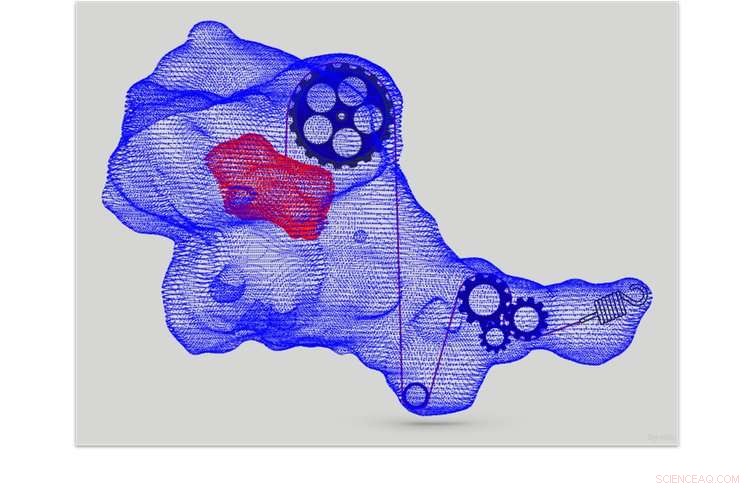
Hver celles cytoskelet fungerer som et system af interne remskiver og strenge. Kredit:Dr Maté Biro, CC BY-SA
Organ på en chip
Organ-on-chip teknologi er designet til at hjælpe med udvikling af lægemidler, sygdomsmodellering og personlig medicin. Hver enkelt enhed er lavet af et gennemsigtigt materiale kendt som en polymer:det er omtrent på størrelse med en USB-stick, og består af hule kanaler beklædt med levende menneskeceller.
Disse chips adskiller sig fra andre laboratorietests såsom cellekultur, i, at de kan efterligne fysiologien og mekanikken i, hvordan celler interagerer med levende væv (i stedet for blot at se på reaktioner i individuelle celler).
For eksempel, organer-på-chips kan genskabe arkitekturen af menneskelige organer på mikroskopisk niveau, inklusive tarmene, nyre, hud, knoglemarv og områder af hjernen.
Et eksempel på brug af lungevæv er beskrevet i videoen nedenfor. Denne teknologi giver mulighed for at se sygdomme i væv, og er et alternativ til dyreforsøg til lægemiddeludvikling.
Mange forskere og bioteknologiske virksomheder håber, at teknologi som organer-på-chips vil fremskynde udviklingen af nye lægemidler, og fremme personlig medicin.
Ved at bruge eksisterende teknikker, kliniske undersøgelser kan tage år at gennemføre, og at teste en enkelt forbindelse kan koste mange millioner dollars. Også, prækliniske dyreforsøg mislykkes ofte i at forudsige menneskelige reaktioner, fordi dyremodeller ikke altid nøjagtigt efterligner menneskelige biologiske reaktioner.
I april 2017 FDA annoncerede en flerårig forsknings- og udviklingsaftale for at evaluere organs-on-chips-teknologi, begyndende med en leverchip.
Aftalen kan udvides i fremtiden til at omfatte yderligere organchips, herunder nyrer, lunge- og tarmmodeller.
Mekanobiologi integrerer fysiske videnskaber i biologi og driver udviklingen af nye teknologier. Se celler i bevægelse, forståelse og måling af kræfter på cellulær skala, og at skabe minimodeller af menneskeligt væv i laboratoriet er kun begyndelsen.
Denne artikel blev oprindeligt publiceret på The Conversation. Læs den originale artikel. 
 Varme artikler
Varme artikler
-
 Er hangry en ægte følelse?Følelse gal og lavt blodsukker? Du kunne være hangry! yuriyzhuravov/iStock/Thinkstock John, hvorfor bliver du så sur? Jeg kiggede på Charlie med dolk. Hvad? Jeg reagerede vantro. Hvorfor er jeg så
Er hangry en ægte følelse?Følelse gal og lavt blodsukker? Du kunne være hangry! yuriyzhuravov/iStock/Thinkstock John, hvorfor bliver du så sur? Jeg kiggede på Charlie med dolk. Hvad? Jeg reagerede vantro. Hvorfor er jeg så -
 Epigenetik forklarer, hvorfor dit DNA ikke forudsiger din skæbneDette billede viser et DNA -molekyle, der er methyleret på begge tråde. Methylering er en type epigenetisk ændring, hvor en methylgruppe tilføjes til en del af et DNA -molekyle og forhindrer den i at
Epigenetik forklarer, hvorfor dit DNA ikke forudsiger din skæbneDette billede viser et DNA -molekyle, der er methyleret på begge tråde. Methylering er en type epigenetisk ændring, hvor en methylgruppe tilføjes til en del af et DNA -molekyle og forhindrer den i at -
 Kæmper med hvid-næse-syndrom hos flagermusKredit:CC0 Public Domain Millioner af flagermus i Nordamerika er blevet udslettet af sygdommen hvidnæse-syndrom forårsaget af svampen Pseudogymnoascus destructans , og forskere bekymrer sig om,
Kæmper med hvid-næse-syndrom hos flagermusKredit:CC0 Public Domain Millioner af flagermus i Nordamerika er blevet udslettet af sygdommen hvidnæse-syndrom forårsaget af svampen Pseudogymnoascus destructans , og forskere bekymrer sig om, -
 Enzymer værd for biobrændstoffer vist i seneste forskningNREL-forskerne Michael Himmel (til venstre), Roman Brunecky, og Yannick Bomble med røntgendiffraktionskilden anvendt til at bestemme strukturen af C. bescii CelA-cellulasen. Kredit:Dennis Schroeder/
Enzymer værd for biobrændstoffer vist i seneste forskningNREL-forskerne Michael Himmel (til venstre), Roman Brunecky, og Yannick Bomble med røntgendiffraktionskilden anvendt til at bestemme strukturen af C. bescii CelA-cellulasen. Kredit:Dennis Schroeder/
- Kontrol af fotoner med en foton
- 17 millioner gallons spildevand udledt fra renseanlæg; nogle LA strande lukket
- Forskere finder en måde at kontrollere, at kvantecomputere returnerer nøjagtige svar
- Ny model forudsiger spredningen af COVID-19 – og hvordan man håndterer finansielle og økonomiske…
- Næsten halvdelen af lejerne i L.A. skylder tilbage husleje
- Luftkvaliteten synker til alvorlig i det disindhyllede New Delhi


