Ny strategi undertrykker uønskede sletningshændelser for at gøre genomredigering sikrere og mere præcis
En enkel og robust strategi udviklet af KAUST-forskere kunne hjælpe med at forbedre sikkerheden og nøjagtigheden af CRISPR-genredigering, et værktøj, der allerede er godkendt til klinisk brug til behandling af arvelige blodsygdomme.
Denne tilgang tackler et kritisk problem med CRISPR-teknologi:handlingen med at skære genomet på bestemte punkter og derefter genføje det, hvilket i sagens natur risikerer at beskadige DNA'et på en måde, der kan forårsage store og uforudsigelige forstyrrelser.
I håb om at afhjælpe dette problem undersøgte et hold ledet af Mo Li, en stamcellebiolog ved KAUST, DNA-reparationsveje, der fører til store genomiske deletioner efter CRISPR-redigering i humane stamceller. Studiet er publiceret i tidsskriftet BMC Biology .
Deres analyse førte dem til en proces kendt som microhomology-mediated end joining (MMEJ), en fejltilbøjelig mekanisme, der, selvom den er i stand til at fikse brud i DNA, ofte efterlader store deletioner i kølvandet.
Forskerne afhørte forskellige gener, der var involveret i denne MMEJ-proces og fandt to, der spillede en central – men modsatrettede – roller i disse uønskede sletningshændelser.
Et gen, kaldet POLQ, viste sig at forværre risikoen for store sletninger efter CRISPR-redigering. Den anden, kaldet RPA, opstod som en genomisk vogter med beskyttende virkninger.
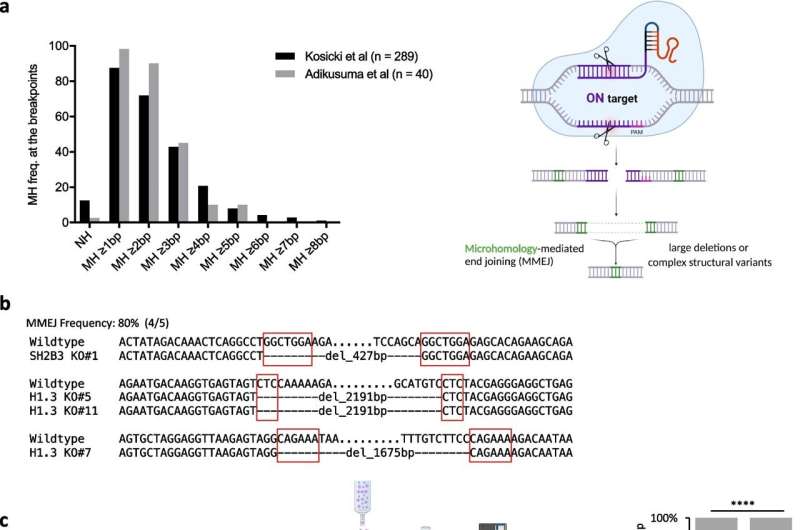
Ved at manipulere disse gener, enten med lægemidler, der hæmmer POLQ eller gennem genetiske teknikker, der booster ekspressionen af RPA, var KAUST-teamet derefter i stand til at reducere forekomsten af skadelige store deletioner uden at kompromittere effektiviteten af genomredigering og dermed bevare den genomiske integritet af redigerede stamceller.
"Denne brugervenlige tilgang kan reducere chancerne for, at disse skadelige store DNA-deletioner sker," siger Baolei Yuan, en tidligere ph.d. studerende i Lis laboratorium og en af undersøgelsens arkitekter sammen med Chongwei Bi og Yeteng Tian fra Lis laboratorium.
Desuden blev de samme indgreb fundet at øge effektiviteten af homologi-styret reparation, en mekanisme kendt for sin evne til at muliggøre nøjagtig genomredigering uden at tilføje utilsigtede mutationer.
Dette var tydeligt i eksperimenter, der involverede stamceller, der bar mutationer i to gener forbundet med seglcellesygdom og Wiskott-Aldrichs syndrom, begge arvelige blodsygdomme. Ved at modulere POLQ eller RPA opnåede forskerne meget præcis og pålidelig genredigering i disse celler.
Resultaterne markerer et væsentligt skridt fremad i at forfine CRISPR-teknologien, hævder Li. "Det er virkelig spændende, fordi det betyder, at vi kommer tættere på sikrere og mere effektive behandlinger af genetiske sygdomme," siger han.
Med en foreløbig patentansøgning indgivet for denne innovative strategi fortsætter teamet med at udforske mekanismerne bag en bredere vifte af uønskede mutationer og finpudse dets teknikker til at gøre CRISPR sikrere og mere effektiv.
"At opnå både høj effektivitet og sikkerhed er fortsat en udfordring, der kræver yderligere udvikling," siger Li, "og vores laboratorium er fortsat på forkant, og søger efter nye løsninger."
Flere oplysninger: Baolei Yuan et al., Modulering af den mikrohomologi-medierede endeforbindelsesvej undertrykker store deletioner og forbedrer homologi-styret reparation efter CRISPR-Cas9-inducerede DNA-brud, BMC Biology (2024). DOI:10.1186/s12915-024-01896-z
Journaloplysninger: BMC Biology
Leveret af King Abdullah University of Science and Technology
 Varme artikler
Varme artikler
-
 At studere døgnrytmer i planter og deres patogener kan føre til præcisionsmedicin for menneskerSelvom det ikke er tydeligt udefra, planter holder tid. Kredit:Hua Lu, CC BY-ND I skumringen, bladene på tamarindtræet lukker, venter på endnu en daggry. Androsthenes, en skibskaptajn under Alexan
At studere døgnrytmer i planter og deres patogener kan føre til præcisionsmedicin for menneskerSelvom det ikke er tydeligt udefra, planter holder tid. Kredit:Hua Lu, CC BY-ND I skumringen, bladene på tamarindtræet lukker, venter på endnu en daggry. Androsthenes, en skibskaptajn under Alexan -
 Hvordan din kost kan forbedre dyrevelfærdenEn systematisk tilgang til at kvantificere indvirkningen af fødevareforbrug på dyrevelfærd er blevet udviklet af forskere fra Institut for Miljøvidenskab, Leiden Universitet i samarbejde med ETH Zür
Hvordan din kost kan forbedre dyrevelfærdenEn systematisk tilgang til at kvantificere indvirkningen af fødevareforbrug på dyrevelfærd er blevet udviklet af forskere fra Institut for Miljøvidenskab, Leiden Universitet i samarbejde med ETH Zür -
 Hajer udviklede flylignende egenskaber, der passer til levestederJean Potvin, Ph.d., fysiker ved Saint Louis University. Kredit:Saint Louis University / Ellen Hutti I et papir udgivet i Proceedings of the Royal Society B:Biologiske videnskaber , forskere rapp
Hajer udviklede flylignende egenskaber, der passer til levestederJean Potvin, Ph.d., fysiker ved Saint Louis University. Kredit:Saint Louis University / Ellen Hutti I et papir udgivet i Proceedings of the Royal Society B:Biologiske videnskaber , forskere rapp -
 Abeundersøgelse viser en vej til overvågning af truede arterEn muriqui -mor med spædbarn. At tælle spædbørn er en nødvendighed for at projicere fremtidige befolkninger. Kredit:Pablo Fernicola En brasiliansk-amerikansk forskningsgruppe har netop offentliggj
Abeundersøgelse viser en vej til overvågning af truede arterEn muriqui -mor med spædbarn. At tælle spædbørn er en nødvendighed for at projicere fremtidige befolkninger. Kredit:Pablo Fernicola En brasiliansk-amerikansk forskningsgruppe har netop offentliggj
- Reddit CEO hævder, at TikTok-appen grundlæggende er parasitisk og spyware
- Fysikere har lært, hvordan man genopretter sammenfiltringen af 'usammenfiltret' kvantelys
- Dødelig storm fortæller om to byer i Macau
- SDSS J1430+1339:Stormen raser i kosmisk tekop
- Lyd: Definition, typer, egenskaber og frekvenser
- Bekræfter tidsmeddelelser om databrud for at begrave de dårlige nyheder


