Opdagelse af en atypisk varmechokfaktor, HSF5, involveret i meiotiske mekanismer har implikationer for mandlig infertilitet
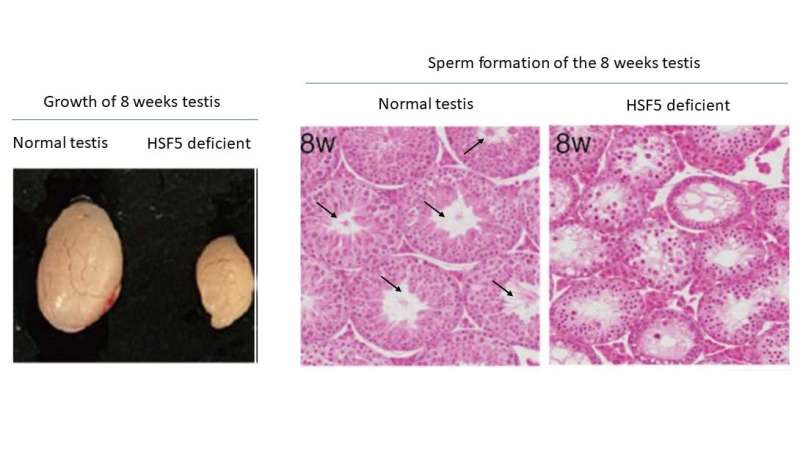
Forskere fra Kumamoto University har identificeret en ny varmechokfaktor (HSF), betegnet som HSF5, som spiller en afgørende rolle i fuldførelsen af meiose og aktiveringen af gener, der er afgørende for sæddannelse. Denne opdagelse giver værdifuld indsigt i de underliggende årsager til spermatogen svigt, den største bidragyder til mandlig infertilitet.
I modsætning til andre typiske varmechokfaktorer, som primært regulerer genekspression som reaktion på stress, såsom varmechok, spiller HSF5 desuden en specifik rolle i mandlig kimproduktion under meiose under ikke-stressforhold.
Ved eukaryot celledeling er genomisk information ligeligt fordelt til datterceller under mitose, hvorimod den halveres under en specialiseret type celledeling kaldet meiose, som er nødvendig for kønscelleproduktion. I mandlige kønsceller følger sæddannelsen afslutningen af meiosen med flere genreguleringsprogrammer.
Imidlertid er mekanismerne, der styrer meiotisk progression, og de specifikke involverede transkriptionsfaktorer stadig dårligt forståede, hvilket udgør betydelige udfordringer inden for reproduktionsmedicin, især hvad angår mandlig infertilitet.
For at løse disse huller, sigter professor Kei-ichiro Ishiguro, adjunkt Ryuki Shimada og deres forskerhold på at klarlægge de mekanismer, der regulerer mandlig meiose, der fører til sædproduktion, med fokus på identifikation og karakterisering af relaterede transkriptionsfaktorer. Artiklen er publiceret i tidsskriftet Nature Communications .
I en tidligere undersøgelse identificerede holdet et meiose-switch-gen MEIOSIN, som aktiverer ekspressionen af hundredvis af gener involveret i sæddannelse. Blandt disse gener opstod varmechokfaktor som et fokus for testiklerne på grund af testiklernes følsomhed over for varmestress, givet deres ydre positionering, som holder en temperatur på 3-4 grader Celsius lavere end kroppens indre temperatur på 37 grader Celsius.
Selvom hovedrollerne af varmechokfaktorer såsom HSF1, HSF2, HSF3 og HSF4 er blevet velidentificeret, er funktionen af HSF5 stadig uklar.
"Om HSF5 deler lignende funktioner med andre varmechokfaktorer eller udviser helt andre funktioner, stiller et spændende spørgsmål, og at tage fat på dette spørgsmål var den oprindelige hensigt med vores undersøgelse," forklarer professor Ishiguro.
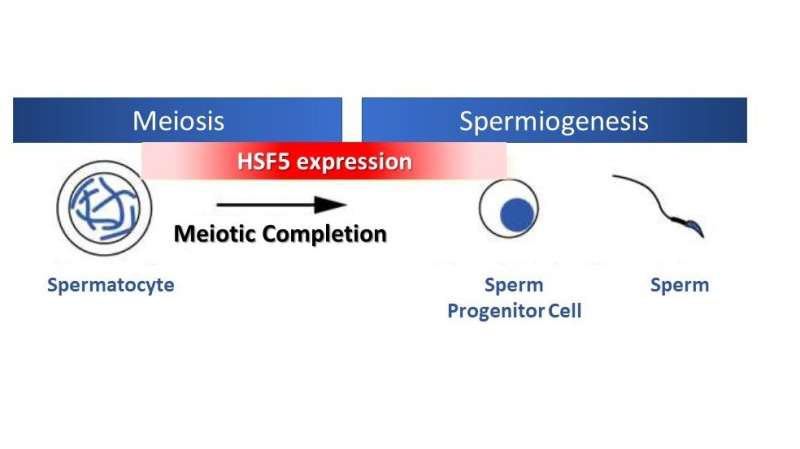
Overraskende nok, forskellig fra andre HSF'er, der reagerer på stress, viste undersøgelsen, at HSF5 spiller en væsentlig rolle i den meiotiske profase-progression i mandlige kønsceller under ikke-stress-forhold. HSF5 er påkrævet for progression ud over pachytenstadiet under spermatogenese, hvilket leder det meiotiske program mod færdiggørelse og aktiverer gener forbundet med sæddannelse.
Ligesom andre transkriptionsfaktorer binder HSF5 til DNA-promotorer for at regulere genekspression. Det, der kendetegner HSF5, er dens unikke målspecificitet. Forskningen afslørede, at det DNA-motiv, det genkender for binding til genpromotoren, adskiller sig fra dem, der er bundet af andre kanoniske HSF-familietransskriptionsfaktorer.
Alle disse fund understreger HSF5's atypiske rolle i genekspression under meiotisk profase hos mænd.
Resultaterne af denne undersøgelse blev valideret gennem eksperimenter på mus, med en afgørende erkendelse af, at HSF5 også er til stede i mennesker. I betragtning af at mange underliggende årsager til infertilitet hos mennesker, især i tilfælde af spermatogen svigt, forbliver uhåndgribelige, forventes resultaterne af denne undersøgelse at bidrage væsentligt til at forstå patogenesen af mandlig infertilitet.
Flere oplysninger: Saori Yoshimura et al., Atypisk varmechok-transskriptionsfaktor HSF5 er kritisk for mandlig meiotisk profase under ikke-stress-forhold, Nature Communications (2024). DOI:10.1038/s41467-024-47601-0
Journaloplysninger: Nature Communications
Leveret af Kumamoto University
 Varme artikler
Varme artikler
-
 Raffinering af pesticider for at dræbe skadedyr, ikke bierForskere ved Michigan State Universitys entomologiske afdeling har låst en nøgle op for at bevare insekticidets effektivitet til at eliminere skadedyr uden at dræbe gavnlige insekter, såsom bier. Stud
Raffinering af pesticider for at dræbe skadedyr, ikke bierForskere ved Michigan State Universitys entomologiske afdeling har låst en nøgle op for at bevare insekticidets effektivitet til at eliminere skadedyr uden at dræbe gavnlige insekter, såsom bier. Stud -
 Donering af din krop til videnskab bliver mere populær i USALægestuderende kigger på deres kadaver efter en dedikations- og velsignelsesceremoni, der hedrer dem, der har doneret deres kroppe til medicinsk uddannelse på Loyola Universitys Stritch School of Medi
Donering af din krop til videnskab bliver mere populær i USALægestuderende kigger på deres kadaver efter en dedikations- og velsignelsesceremoni, der hedrer dem, der har doneret deres kroppe til medicinsk uddannelse på Loyola Universitys Stritch School of Medi -
 Hvidt kød eller mørkt kød? Serverer big data for at tyde Thanksgiving-middagWill Stone, Kat Hayes, og Duke Nguyen taler om kalkun, mens de gennemgår data fra massespektrometeret. Kredit:Virginia Tech For Virginia Tech biokemi hovedfag Cat Hayes, hertug Nguyen, og Will Sto
Hvidt kød eller mørkt kød? Serverer big data for at tyde Thanksgiving-middagWill Stone, Kat Hayes, og Duke Nguyen taler om kalkun, mens de gennemgår data fra massespektrometeret. Kredit:Virginia Tech For Virginia Tech biokemi hovedfag Cat Hayes, hertug Nguyen, og Will Sto -
 Tavs kode af nukleotider, ikke aminosyrer, bestemmer funktioner af vitale proteinerActin er et rigeligt protein, til stede i hver celle. Penn Vet-forskere viste, at forskelle i rækkefølgen af nukleotider - ikke aminosyrerne - styrede de forskellige funktioner af to former for acti
Tavs kode af nukleotider, ikke aminosyrer, bestemmer funktioner af vitale proteinerActin er et rigeligt protein, til stede i hver celle. Penn Vet-forskere viste, at forskelle i rækkefølgen af nukleotider - ikke aminosyrerne - styrede de forskellige funktioner af to former for acti
- Hvad ildmyrer kan lære os om at lave bedre selvhelbredende materialer
- Motorola foldbar dominerer patentsnakken som et friskere comeback
- Colorados-skovbrande skove viser begrænset genopretning
- Monsterkartelafgift sætter bremser på BMWs indtjening
- Kollektiv adfærdsforskning afslører hemmeligheder bag succesfulde fodboldhold
- Real-time billeddannelse til brug i medicin


