Tavs kode af nukleotider, ikke aminosyrer, bestemmer funktioner af vitale proteiner
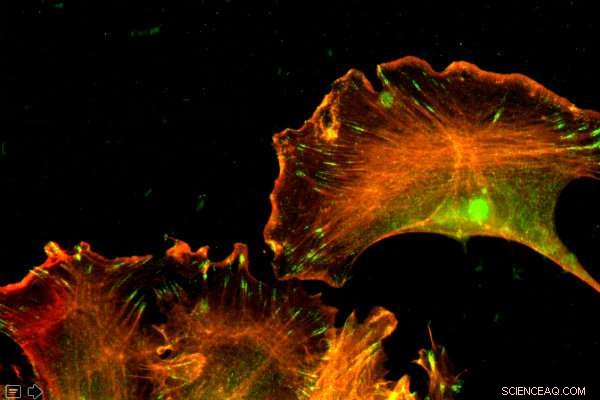
Actin er et rigeligt protein, til stede i hver celle. Penn Vet-forskere viste, at forskelle i rækkefølgen af nukleotider - ikke aminosyrerne - styrede de forskellige funktioner af to former for actin. Kredit:University of Pennsylvania
Mennesker har seks former for proteinet actin, som udfører væsentlige funktioner i kroppen. Især to, β-actin og γ-actin, er næsten identiske, kun adskiller sig med fire aminosyrer. Alligevel udfører disse næsten tvillingeproteiner forskellige roller. Et langvarigt spørgsmål til biologer har været, hvordan er det muligt?
"Det er et mysterium, der er blevet diskuteret på området i de sidste 40 år, " sagde Anna Kashina, professor i biokemi ved University of Pennsylvania School of Veterinary Medicine.
Nye fund fra Kashina og kolleger har peget på et overraskende svar. Disse proteiners forskellige funktioner bestemmes ikke af deres aminosyresekvenser, men af deres genetiske kode.
"Vi kan godt lide at kalde det 'den stille kode' "" sagde Kashina. "Vores resultater viser, at de dele af gener, som vi tænker på som værende tavse, faktisk koder for meget vigtig funktionel information."
Forskerne fandt ud af, at disse "tavse" forskelle i nukleotidsekvensen synes at påvirke tætheden af ribosomer, de molekylære maskiner, der omsætter RNA til proteiner. Sådanne forskelle kan gøre det muligt for hver enkelt aktinform at påtage sig en anden rolle i cellen.
Kashina var medforfatter til værket, offentliggjort i tidsskriftet eLife , med Penn Vet's Pavan Vedula, Satoshi Kurosaka, Nicolae Adrian Leu, Junling Wang, Stephanie Sterling og Dawei Dong og National Institutes of Healths Yuri I. Wolf og Svetlana A. Shabalina.
Actin er så allestedsnærværende og essentielt, at det er kendt som et "husholdningsprotein". Det er det mest rigelige protein i de fleste celler, og dets forskellige former spiller roller under cellemigration, muskelsammentrækning og udvikling. For en tid, videnskabsmænd mente, at de forskellige former var funktionelt overflødige, eksisterede kun for at tjene som backup, hvis en formular havde en defekt.
For nylig, forskere er kommet til at forstå, at formerne ikke er overflødige; nogle lokaliseres til forskellige dele af cellerne, nogle er inkorporeret i forskellige dele af cytoskelettet. Og når der bliver pillet ved disse proteiner, resultaterne er også forskellige.
Når β-aktin mangler, for eksempel, mus dør på et tidligt stadium af embryonal udvikling. Men mus der mangler γ-aktin, dog typisk mindre end normalt og døv, kan overleve til voksenlivet.
I en rapport fra 2010 i Science, Kashinas gruppe tog et skridt i retning af at få en forståelse af, hvad der bestemmer disse forskelle. Ser man på en proteinmodifikation, der normalt kun findes i β-actin, de fandt ud af, at grunden til, at det ikke også var til stede på y-actin, skyldtes variationer i den kodende sekvens mellem de to actingener.
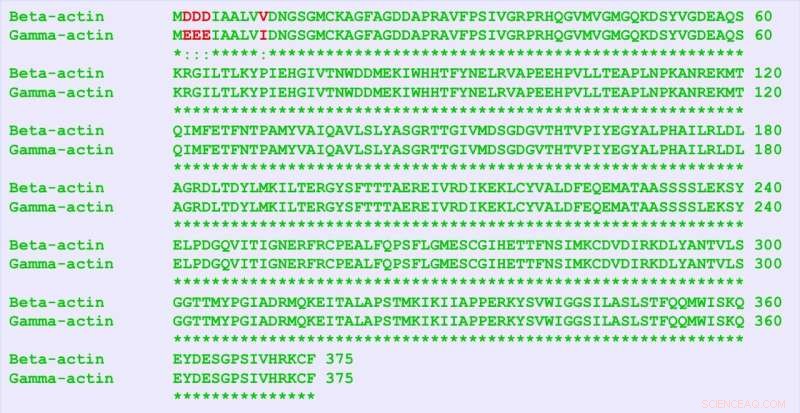
β-actin og γ-actin er næsten identiske proteiner, kun adskiller sig med fire aminosyrer (i rødt). Men de indeholder mange flere forskelle i deres nukleotidsekvens, og denne "stille kode" er ansvarlige forskellige funktioner af de to proteiner, fandt forskerne. Kredit:University of Pennsylvania
"Vi ville bygge videre på dette, " sagde Kashina, "og besluttede at teste hypotesen, 'Hvad nu hvis deres funktionelle forskelle ikke havde noget at gøre med deres aminosyresekvens; hvad hvis det hele er i generne?'"
Forskerne udnyttede den præcisionsgenredigering, der blev muliggjort af CRISPR/Cas-9-systemet. Mens de to actinisoformer kun adskiller sig med fire aminosyrer, deres mRNA-kodende sekvenser adskiller sig med næsten 13 procent på grund af "tavse" nukleotidforskelle, der ikke desto mindre koder for de samme aminosyrer. Foretag ændringer til kun fem nukleotider i β-actingenet, de var i stand til at transformere det, så dets aminosyreoutput ville være nøjagtigt det samme som γ-actin-proteinet. Alt, der ville skelne det, ville være de tavse nukleotidsubstitutioner.
Genredigeringen virkede. Mus med disse redigeringer havde intet β-actin-protein. Men i modsætning til ægte β-aktin knockouts var de fuldstændig sunde og levedygtige, ligesom om de besad de rigtige forhold af β-actin og γ-actin proteiner. De overlevede for at formere sig og havde i gennemsnit samme kuldstørrelse som normale dyr.
Forskerne udførte det samme eksperiment, redigerede y-actin-genet til at kode for β-actin-proteinet, men var kun i stand til at ændre den kodende sekvens for tre af de fire aminosyrer. Stadig, mus udsat for denne delvise udskiftning så også normale og sunde ud, på trods af manglende γ-actin protein.
I opfølgende forsøg, Kashinas team fandt ud af, at γ-actin-proteinerne fremstillet af det redigerede β-actin-gen dannede et normalt cytoskelet og gjorde det muligt for celler at migrere på en normal måde.
"Hvis kun nukleotidsekvensen er vigtig for proteinfunktionen, så burde musene være ligeglade med hvilket protein de har, " sagde Kashina. "Og musene var ligeglade."
At finde en mekanisme for, hvordan DNA-sekvensen kan påvirke proteinfunktionen, forskerne fandt ud af, at ribosomes tæthed på β-actin RNA er mere end tusind gange højere end på γ-actin RNA, og faktisk havde alle seks actingener forskelle i ribosomdensitet.
"Dette tyder på, at β-actin kunne omsættes til protein måske tusind gange hurtigere end γ-actin, " sagde Kashina.
Og nysgerrig efter hvor udbredt dette fænomen kan være, forskerne ledte efter proteinfamilier med næsten identiske medlemmer, der er kodet af forskellige gener og havde betydelige variationer i ribosomtæthed på tværs af familien. De fandt mange grupper, der blev delt på tværs af mus, zebrafisk og menneskelige genomer.
"Vi mener, at denne form for funktionel regulering er et globalt fænomen, " sagde Kashina, og det er en, hendes laboratorium vil fortsætte med at undersøge.
 Varme artikler
Varme artikler
-
 Endoplasmatisk retikulum (ru og glat): Struktur og funktion (med diagram)En af de enkleste måder at forstå strukturer og funktioner på de organeller, der er indeholdt i en celle - og cellebiologi som helhed - er at sammenligne dem med ting fra den virkelige verden. Fo
Endoplasmatisk retikulum (ru og glat): Struktur og funktion (med diagram)En af de enkleste måder at forstå strukturer og funktioner på de organeller, der er indeholdt i en celle - og cellebiologi som helhed - er at sammenligne dem med ting fra den virkelige verden. Fo -
 Er der virkelig en Cork -krise?Korktræer fældes ikke i høstprocessen. Kun barken fjernes fra korken, og det regenererer hvert niende eller tiende år. Martin Child/robertharding/Getty Images/Collection Mix:Sub Du har måske (eller m
Er der virkelig en Cork -krise?Korktræer fældes ikke i høstprocessen. Kun barken fjernes fra korken, og det regenererer hvert niende eller tiende år. Martin Child/robertharding/Getty Images/Collection Mix:Sub Du har måske (eller m -
 Kombinerer teknologi og gammel sporing for at redde gepardenKredit:Heriot-Watt University En life scientist fra School of Energy, Geovidenskab, Infrastructure and Society undersøger, om teknologi kan kombineres med namibiske jæger-samleres ældgamle sporing
Kombinerer teknologi og gammel sporing for at redde gepardenKredit:Heriot-Watt University En life scientist fra School of Energy, Geovidenskab, Infrastructure and Society undersøger, om teknologi kan kombineres med namibiske jæger-samleres ældgamle sporing -
 Overraskende hurtig evolution observeret i firfirtsarterEn grøn anole firben ( Anolis carolinensis ) står på et grønt blad i den tidlige morgensol. Jeff R Clow/Getty Images Evolution tager tid. Men det er bare hvor lang tid det tager. Hvor længe, for ek
Overraskende hurtig evolution observeret i firfirtsarterEn grøn anole firben ( Anolis carolinensis ) står på et grønt blad i den tidlige morgensol. Jeff R Clow/Getty Images Evolution tager tid. Men det er bare hvor lang tid det tager. Hvor længe, for ek
- NASA -vanddampdata viser, at cimaron lander i Japan
- Musk viser fremskridt på hjerne-maskine-grænsefladen
- Robotbåd sejler ind i historien ved at afslutte Atlanterhavet
- Solcelledrevet rover nærmer sig 5, 000. Mars -daggry
- Nærliggende stjernedannende region giver spor til dannelsen af vores solsystem
- Coronavirus:Pinterest lancerer ny fane I dag, som vil tilbyde råd fra sundhedsagenturer


