Afsløring af mysterierne om celledeling i embryoner med timelapse-fotografering
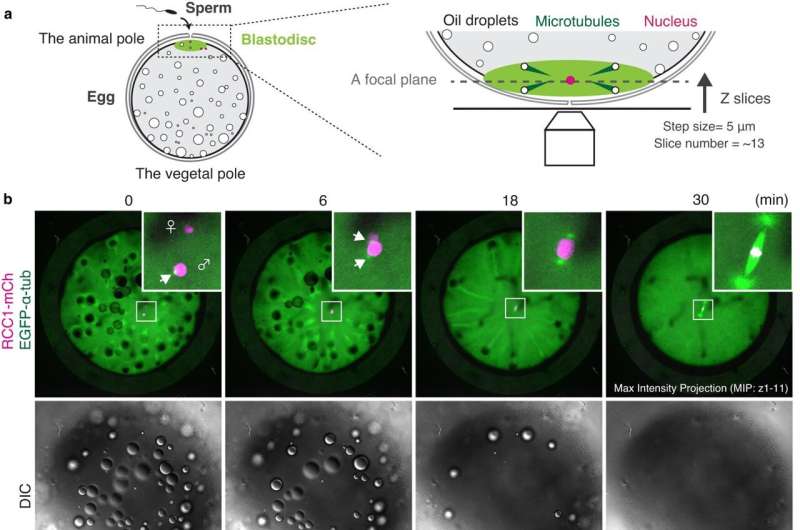
Livets begyndelse er indhyllet i mystik. Mens mitosens indviklede dynamik er velundersøgt i de såkaldte somatiske celler - de celler, der har en specialiseret funktion, som hud- og muskelceller - forbliver de undvigende i de første celler i vores kroppe, de embryonale celler. Embryonal mitose er notorisk vanskelig at studere hos hvirveldyr, da levende funktionelle analyser og billeddannelse af eksperimentelle embryoner er teknisk begrænset, hvilket gør det svært at spore celler under embryogenese.
Forskere fra Cell Division Dynamics Unit ved Okinawa Institute of Science and Technology (OIST) har imidlertid udgivet en artikel i Nature Communications , sammen med professorerne Toshiya Nishimura fra Hokkaido Universitet (tidligere ved Nagoya Universitet), Minoru Tanaka fra Nagoya Universitet, Satoshi Ansai fra Tohoku Universitet (i øjeblikket ved Kyoto Universitet) og Masato T. Kanemaki fra National Institute of Genetics.
Undersøgelsen tager de første store skridt i retning af at besvare spørgsmål om embryonal mitose takket være en kombination af nye billedbehandlingsteknikker, CRISPR/Cas9-genomredigeringsteknologi, et moderne protein-knockdown-system og medaka eller japansk risfisk (Oryzias latipes).
De timelapses, som de har produceret, hjælper med at besvare grundlæggende spørgsmål om den indviklede proces med at dele kromosomer ligeligt under embryonal mitose, og kortlægger samtidig den næste grænse for videnskabelig udforskning. Som professor Tomomi Kiyomitsu, seniorforfatter af undersøgelsen, beskriver timelapses og siger:"De er smukke, både alene og fordi de lægger et nyt grundlag for at belyse embryonal mitose."
Centralt for mysteriet med embryonal mitose er det afgørende trin, når kromosomerne, som indeholder al cellens genetiske information, er justeret og adskilt ligeligt i datterceller. En nøglespiller i denne proces er den mitotiske spindel, som er lavet af mikrotubuli - lange proteinfibre, der bruges til intracellulær struktur og transport - der udstråler fra modsatte poler af spindlen og hæfter til kromosomerne i midten. Spindlen fanger duplikerede kromosomer korrekt og adskiller dem ligeligt i dattercellerne under deling.
Der er mange faktorer, der bestemmer spindeldannelsen, og en af disse er proteinet Ran-GTP, som spiller en væsentlig rolle i celledeling af kvindelige reproduktive celler, som mangler centrosomer - celleorganeller, der er ansvarlige for at samle mikrotubuli - men ikke i små somatiske celler, som har centrosomer. Det har dog længe været uklart, om Ran-GTP er påkrævet til spindelsamling i hvirveldyr tidlige embryoner, som indeholder centrosomer, men har unikke egenskaber, såsom en større cellestørrelse.
I modsætning til pattedyrs tidlige embryoner er embryonale celler i fisk gennemsigtige og udvikler sig synkront i et ensartet, enkeltcellet lagark, hvilket gør dem betydeligt nemmere at spore. Medakaen viste sig at være særligt velegnet til forskerne, da disse fisk tåler en lang række temperaturer, producerer æg dagligt og har et relativt lille genom.
At være temperaturtolerante betyder, at medaka embryonale celler kan overleve ved stuetemperatur, hvilket gør dem særligt velegnede til langtidsfotografering i live timelapse.
Det faktum, at medaka producerer æg ofte og har en relativt lille genomstørrelse, gør dem til gode kandidater til CRISPR/Cas9-medieret genomredigering. Med denne teknologi har forskerne skabt genetisk modificeret eller transgene medaka, hvis embryonale celler bogstaveligt talt fremhæver dynamikken i visse proteiner involveret i mitose.
Ved at studere timelapses af den udviklende mitotiske spindel i levende, transgene medaka-embryoner, opdagede forskerne, at store tidlige embryoner samler unikke spindler, der er forskellige fra somatiske spindler. Derudover spiller Ran-GTP en afgørende rolle i spindeldannelse i tidlige embryonale opdelinger, men betydningen aftager i embryoner på senere stadier. Dette skyldes muligvis, at spindelstrukturen ombygges, efterhånden som celler bliver mindre under udvikling, selvom den nøjagtige årsag er et emne for fremtidig forskning.
Forskerne opdagede også, at de tidlige embryonale celler ikke har et dedikeret spindelsamlingskontrolpunkt, som kendetegner de fleste somatiske celler, og som tjener til at sikre, at kromosomerne er korrekt justeret før segregering.
Som professor Kiyomitsu siger:"Kontrolpunktet er ikke aktivt, og alligevel er kromosomadskillelserne stadig meget nøjagtige. Dette kan forklares med, at embryonale celler skal dele sig meget hurtigt, men det er noget, vi gerne vil undersøge nærmere."
Mens genetisk modificering af medaka-fisken og undersøgelse af de tidlige embryoner har ført til ny nøgleindsigt i embryonal mitose, er dette kun begyndelsen for professor Kiyomitsu og holdet.
Ud over spørgsmål relateret til Ran-GTP's aftagende rolle i senere faser og kontrolpunktet for manglende spindelsamling, peger han på den tilfredsstillende symmetri af celledelinger i timelapses. "Spindeldannelsen er kendetegnet ved en høj grad af symmetri, da cellerne ser ud til at dele sig i de størrelser og definerede retninger, og spindlen er konsekvent i midten af cellerne. Hvordan kan spindlen orientere sig så regelmæssigt på tværs af cellerne. , og hvordan er det i stand til at finde centret hver gang?"
Ud over timelapsene håber holdet også at styrke dette nye fundament yderligere med yderligere medaka-genlinjer, der kan tjene som modeller for forskning i embryonale celler og samtidig optimere genomredigeringsprocessen.
Til sidst ønsker holdet at teste for generaliserbarhed af deres fund ved at studere embryonal mitose i andre organismer, og på et senere tidspunkt ønsker de at udforske udviklingen af spindelsamling og embryonale divisioner, hvilket også ville bidrage til en bedre forståelse af menneskelig embryogenese og til at udvikle diagnose og behandling af menneskelig infertilitet.
"Med dette papir har vi skabt et solidt fundament," siger professor Kiyomitsu, "men vi har også åbnet en ny grænse. Embryonal mitose er smuk, mystisk og udfordrende at studere, og vi håber, at vi med vores arbejde i sidste ende kan komme lidt tættere på at forstå de indviklede processer i begyndelsen af livet."
Flere oplysninger: Ai Kiyomitsu et al, Ran-GTP samler en specialiseret spindelstruktur til nøjagtig kromosomsegregation i medaka tidlige embryoner, Nature Communications (2024). DOI:10.1038/s41467-024-45251-w
Journaloplysninger: Nature Communications
Leveret af Okinawa Institute of Science and Technology
 Varme artikler
Varme artikler
-
 Heste kan læse vores kropssprog, selv når de ikke kender osAmy Smith med Red. Kredit:University of Sussex Heste kan se forskel på dominerende og underdanige kropsstillinger hos mennesker, selv når mennesker ikke kender dem, ifølge en ny University of Suss
Heste kan læse vores kropssprog, selv når de ikke kender osAmy Smith med Red. Kredit:University of Sussex Heste kan se forskel på dominerende og underdanige kropsstillinger hos mennesker, selv når mennesker ikke kender dem, ifølge en ny University of Suss -
 Mimetoliths:De ansigter, vi ser i klippeformationerThe Old Man of the Mountain levede på et udkanten i Franconia Notch, New Hampshire, og var en af de mest kendte mimetolitter i USA, før den faldt i 2003. Libraray of Congress Et almindeligt begreb,
Mimetoliths:De ansigter, vi ser i klippeformationerThe Old Man of the Mountain levede på et udkanten i Franconia Notch, New Hampshire, og var en af de mest kendte mimetolitter i USA, før den faldt i 2003. Libraray of Congress Et almindeligt begreb, -
 Det er nødvendigt at bygge bro mellem to jærvebestande i Fennoskandia for bevarelseI jærvundersøgelsen i Finland bruges hårindsamlingssteder til at indsamle hårprøver til genetisk forskning, som på billedet. Kredit:Natural Resources Institute Finland / Tapio Visuri En ny undersøg
Det er nødvendigt at bygge bro mellem to jærvebestande i Fennoskandia for bevarelseI jærvundersøgelsen i Finland bruges hårindsamlingssteder til at indsamle hårprøver til genetisk forskning, som på billedet. Kredit:Natural Resources Institute Finland / Tapio Visuri En ny undersøg -
 Flerfarvede planter er pludselig et must-have i boligindretningen. Sådan holder du dem i liveKredit:Shutterstock Mode og mode har altid påvirket de planter, vi holder. Og sådan er det også med brogede planter, som i disse dage er blevet meget populære blandt indendørs planteentusiaster. B
Flerfarvede planter er pludselig et must-have i boligindretningen. Sådan holder du dem i liveKredit:Shutterstock Mode og mode har altid påvirket de planter, vi holder. Og sådan er det også med brogede planter, som i disse dage er blevet meget populære blandt indendørs planteentusiaster. B
- Billede:Fuego plume
- Ny teori om oprindelsen af mørkt stof
- Undersøgelse fremhæver vigtigheden af pårørendes velvære i Uganda
- Små bobler tager et kvantespring
- Hvad sker der med volumenet af en gas under komprimering?
- Stående skriveborde:Skolebørn vælger at stå i klassen, når de får muligheden, ny undersøgelse…


