Et denatureret protein kan omdannes til sin funktionelle form, når det returneres normalt miljø. Hvad betyder det om en bekræftelse?
Når et protein denatureres, afbrydes dets struktur, og dets polypeptidkæder udfoldes. Dette kan forekomme på grund af ændringer i temperatur, pH eller opløsningsmiddelforhold. I den denaturerede tilstand kan proteinet ikke udføre sin funktion korrekt, fordi dets aktive sted ikke længere er korrekt placeret.
Men når det denaturerede protein returneres til et normalt miljø, kan polypeptidkæderne spontant refolde til den korrekte konformation. Denne proces kaldes proteinfoldning, og den er drevet af en række faktorer, herunder den hydrofobe effekt, hydrogenbinding og van der Waals-kræfter.
Et proteins evne til at refolde til dets funktionelle form er afgørende for dets biologiske aktivitet. Det indikerer også, at proteinets konformation ikke er stift fast, men snarere kan tilpasse sig forskellige miljøer. Denne fleksibilitet er et nøgletræk ved proteiner, der gør det muligt for dem at udføre en bred vifte af funktioner i levende organismer.
Sidste artikelHvordan dannes lapis lazuli?
Næste artikelHvad er de tre komponenter i et DNA-molekyle?
 Varme artikler
Varme artikler
-
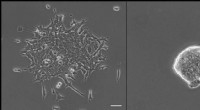 Subtile tegn kan diktere stamcellernes skæbneInhibering af GSK3 er afgørende for opretholdelse af embryonale stamcelle (ESC) identitet (venstre panel, ESCer differentierer uden inhibering af GSK3; højre panel, flotte selvfornyende ESCer, når GSK
Subtile tegn kan diktere stamcellernes skæbneInhibering af GSK3 er afgørende for opretholdelse af embryonale stamcelle (ESC) identitet (venstre panel, ESCer differentierer uden inhibering af GSK3; højre panel, flotte selvfornyende ESCer, når GSK -
 Fisk reagerer på rovdyrangreb ved at fordoble vækstratenTerence Barry, seniorforsker i dyrevidenskab, viser en af mange tanke med fisk, der bliver undersøgt på Water Science and Engineering Laboratory, hvor han forsker i akvakultur og stressreaktionen ho
Fisk reagerer på rovdyrangreb ved at fordoble vækstratenTerence Barry, seniorforsker i dyrevidenskab, viser en af mange tanke med fisk, der bliver undersøgt på Water Science and Engineering Laboratory, hvor han forsker i akvakultur og stressreaktionen ho -
 Indfødte fiskearter i fare efter fjernelse af vand fra Colorado -flodenKrukker med konserverede fiskeprøver fra Scripps Institution of Oceanography, der blev brugt i denne undersøgelse. Kredit:Clive Lau. Landbrug og huslige aktiviteter forbruger meget af Colorado Riv
Indfødte fiskearter i fare efter fjernelse af vand fra Colorado -flodenKrukker med konserverede fiskeprøver fra Scripps Institution of Oceanography, der blev brugt i denne undersøgelse. Kredit:Clive Lau. Landbrug og huslige aktiviteter forbruger meget af Colorado Riv -
 Knivløberben giver lemlæstet thailandske hund nyt livDe lette ben var skræddersyet til den højenergiske jagthund Godt et år efter at han blev lemlæstet for at gnave i andres sko, Cola tumler over en strand på nye slanke poter:buede blade runner prot
Knivløberben giver lemlæstet thailandske hund nyt livDe lette ben var skræddersyet til den højenergiske jagthund Godt et år efter at han blev lemlæstet for at gnave i andres sko, Cola tumler over en strand på nye slanke poter:buede blade runner prot
- Måleinstrumenter og anvendelser
- Billede:Semarang, Indonesien
- Kvanteelektrodynamik testet 100 gange mere præcist end nogensinde
- Kynisme, autonomi og arbejdsglæde:Beviser fra lærerprofessionen
- Fysikere kaster nyt lys over, hvordan væsker opfører sig med andre materialer
- Snurrer mod robust mikrobølge generation på nano skala


