Hvilke funktionelle grupper findes i insulin?
* aromatiske ringe: Tyrosin, phenylalanin og tryptophan -rester bidrager til hormonens struktur og interaktioner med dens receptor.
* opladede rester: Lysin- og argininrester er positivt ladet og deltager i elektrostatiske interaktioner. Glutaminsyre- og asparaginsyrerester er negativt ladet og bidrager også til elektrostatiske interaktioner.
* polære rester: Serin-, threonin- og asparaginrester bidrager til hydrogenbindingsinteraktioner.
* Hydrofobe rester: Leucin, isoleucin, valin og alaninrester bidrager til hydrofobe interaktioner, som hjælper med at folde proteinet i dets korrekte tredimensionelle form.
Det er vigtigt at bemærke, at det specifikke arrangement af disse aminosyresidekæder sammen med den samlede tertiære struktur af insulin er afgørende for dens biologiske aktivitet.
Selvom insulin ikke indeholder traditionelle funktionelle grupper, har det en unik sammensætning af aminosyresidekæder, der bidrager til dens struktur og funktion.
Sidste artikelHvor er aminosyrer i cellen?
Næste artikelEr udtrykket cerebral dominans udpeget den halvkugle, der er dominerende for sprog?
 Varme artikler
Varme artikler
-
 Arter kan virke bedragerisk modstandsdygtige over for klimaændringerMuslingebede ved Bodega Marine Reserve. Kredit:Laura Jurgens Naturen i sig selv kan være det bedste forsvar mod klimaændringer for mange arter - i hvert fald på kort sigt - ifølge en undersøgelse
Arter kan virke bedragerisk modstandsdygtige over for klimaændringerMuslingebede ved Bodega Marine Reserve. Kredit:Laura Jurgens Naturen i sig selv kan være det bedste forsvar mod klimaændringer for mange arter - i hvert fald på kort sigt - ifølge en undersøgelse -
 Datamodellering er nøglen til bæredygtig forvaltning af fiskeriRock flathead er en af Australiens yndlingsfisk. Kredit:Alpha/Flickr Har du nogensinde stillet spørgsmålstegn ved den miljømæssige eller økonomiske bæredygtighed af det fladehoved, du bestiller
Datamodellering er nøglen til bæredygtig forvaltning af fiskeriRock flathead er en af Australiens yndlingsfisk. Kredit:Alpha/Flickr Har du nogensinde stillet spørgsmålstegn ved den miljømæssige eller økonomiske bæredygtighed af det fladehoved, du bestiller -
 Kunstige neurale netværk kunne drive kurering af naturhistoriske samlingerSmithsonian -forskere klassificerede digitaliserede herbariumark, der er blevet farvet med kviksølv, til at bygge et træningsdatasæt. Kredit:Paul B. Frandsen, Smithsonian Millioner, hvis ikke mill
Kunstige neurale netværk kunne drive kurering af naturhistoriske samlingerSmithsonian -forskere klassificerede digitaliserede herbariumark, der er blevet farvet med kviksølv, til at bygge et træningsdatasæt. Kredit:Paul B. Frandsen, Smithsonian Millioner, hvis ikke mill -
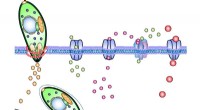 Hvordan toxoplasmose udnytter immunceller til at nå hjernenBilledet illustrerer Toxoplasma gondii tachyzoitter, der invaderer på tværs af cellemembranen i en værtscelle. Ved invasion, en signaleringskaskade aktiveres via kloridkanaler, GABA-kanaler og calci
Hvordan toxoplasmose udnytter immunceller til at nå hjernenBilledet illustrerer Toxoplasma gondii tachyzoitter, der invaderer på tværs af cellemembranen i en værtscelle. Ved invasion, en signaleringskaskade aktiveres via kloridkanaler, GABA-kanaler og calci


