Nogle enzymatisk regulering er allosterisk i sådanne tilfælde, som af følgende vil normalt blive fundet?
allosterisk regulering
* Definition: Allosterisk regulering er en måde at kontrollere enzymaktivitet ved at binde molekyler (kaldet *allosteriske effektorer *) til steder på enzymet, der er forskellige fra det aktive sted. Denne binding ændrer enzymets form og ændrer dens aktivitet.
* Typer af allosteriske effektorer:
* aktivatorer: Bind til enzymet og øg dets aktivitet.
* Inhibitorer: Bind til enzymet og mindsk dets aktivitet.
* mekanisme: Bindingen af et effektormolekyle til det allosteriske sted kan forårsage en konformationel ændring i enzymet. Denne ændring kan enten gøre det aktive sted mere tilgængeligt for substratet (aktivering) eller mindre tilgængeligt (inhibering).
hvad du normalt ville finde i allosterisk regulering:
1. kvartær struktur: Allosteriske enzymer har ofte flere underenheder (f.eks. En dimer eller tetramer). Interaktionen mellem disse underenheder muliggør kooperativ binding af substrater og effektorer.
2. Flere bindingssteder: Allosteriske enzymer har separate aktive steder til substratbinding og allosteriske steder til effektorbinding.
3. sigmoidal kinetik: Når de er afbildet på en graf over enzymaktivitet versus substratkoncentration, viser allosteriske enzymer en sigmoidal (S-formet) kurve. Dette er på grund af den kooperative binding af substratmolekyler.
4. regulatoriske steder: Disse steder adskiller sig fra det aktive sted og binder allosteriske effektorer.
5. konformationelle ændringer: Bindingen af allosteriske effektorer forårsager en ændring i enzymets form, som enten kan øge eller reducere aktiviteten på det aktive sted.
Eksempler på allosteriske enzymer:
* phosphofructokinase-1 (PFK-1) i glycolyse: PFK-1 aktiveres af ADP og inhiberes af ATP og citrat.
* hæmoglobin: Bindingen af ilt til en underenhed af hæmoglobin øger affiniteten af de andre underenheder til ilt, hvilket fører til kooperativ binding.
Nøglepunkter:
* Allosterisk regulering er en afgørende mekanisme til kontrol af metaboliske veje, hvilket sikrer, at enzymer kun er aktive, når det er nødvendigt.
* Ved binding på allosteriske steder kan effektormolekyler finjustere enzymaktivitet som respons på ændringer i cellulære forhold.
 Varme artikler
Varme artikler
-
 DNA -forskere opfordrer knogleholdere til at dele knogleadgangMenneskelige rester fra arkæologiske udgravninger kan indeholde værdifuldt genetisk materiale. Forfatterne til et brev i tidsskriftet Nature har opfordret til mere åbenhed og adgang til forskning. Ari
DNA -forskere opfordrer knogleholdere til at dele knogleadgangMenneskelige rester fra arkæologiske udgravninger kan indeholde værdifuldt genetisk materiale. Forfatterne til et brev i tidsskriftet Nature har opfordret til mere åbenhed og adgang til forskning. Ari -
 Personlighed og humørsvingninger hos bakterierKunstnerindtryk af en E. coli bakterie, der bevæger sig ved hjælp af flageller. Kredit:AMOLF Bakterier kan styre, hvor de går hen, ved hjælp af et signalnetværk af proteinmolekyler. Forskere ved A
Personlighed og humørsvingninger hos bakterierKunstnerindtryk af en E. coli bakterie, der bevæger sig ved hjælp af flageller. Kredit:AMOLF Bakterier kan styre, hvor de går hen, ved hjælp af et signalnetværk af proteinmolekyler. Forskere ved A -
 Genmodificerede lilla tomater kommer muligvis til en amerikansk købmand i nærheden af digKredit:Apelsinskal, CC BY-SA 4.0 , via Wikimedia Commons Nogle gartnere dyrker tomater i en regnbue af farver, herunder rød, gul, orange, grøn og endda bordeaux. Men lilla? Det amerikanske landbr
Genmodificerede lilla tomater kommer muligvis til en amerikansk købmand i nærheden af digKredit:Apelsinskal, CC BY-SA 4.0 , via Wikimedia Commons Nogle gartnere dyrker tomater i en regnbue af farver, herunder rød, gul, orange, grøn og endda bordeaux. Men lilla? Det amerikanske landbr -
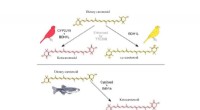 Gen, der er ansvarlig for rød farve i fugle fundetGrafisk abstrakt. Kredit:Current Biology (2022). DOI:10.1016/j.cub.2022.08.013 Et internationalt hold af forskere har fundet generne, der er ansvarlige for at omdanne gule carotenoider i fugle til
Gen, der er ansvarlig for rød farve i fugle fundetGrafisk abstrakt. Kredit:Current Biology (2022). DOI:10.1016/j.cub.2022.08.013 Et internationalt hold af forskere har fundet generne, der er ansvarlige for at omdanne gule carotenoider i fugle til
- Hvad er referencepunktet for gravititions Potentiel Energy?
- Tyrkiet-Syrien jordskælv:En seismolog forklarer, hvad der er sket
- Uddybende spørgsmål:Hvor godt forudsiger vi oversvømmelser?
- Med hensyn til det geografiske tema placering versus sted adskiller sted sig fra, at det fokuserer m…
- Humlende rumstøv får asteroider til at se mere rå ud
- Hvorfor kaldes celle livets enhed?


