Røntgenlaser får første øjebliksbilleder i realtid af et kemikalie, der vender en biologisk switch
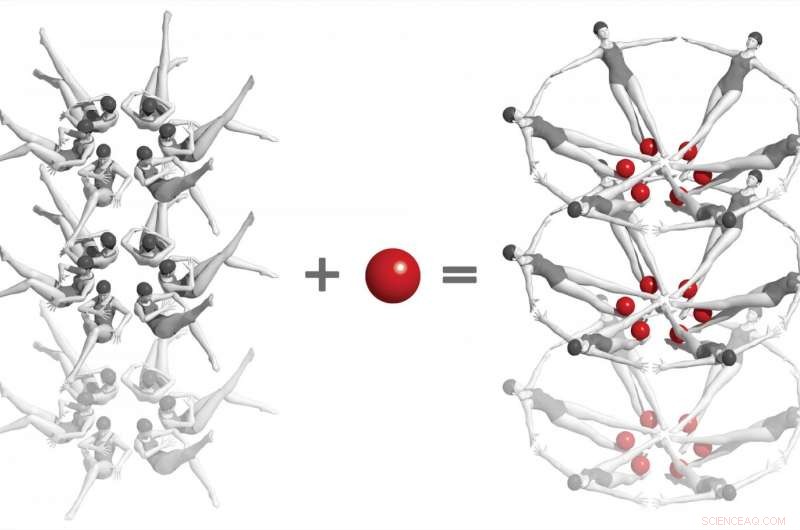
I et skelsættende eksperiment på SLAC National Accelerator Laboratory, forskere brugte en røntgenlaser til at fange de første øjebliksbilleder af en kemisk interaktion mellem to biomolekyler i realtid og på atomniveau. Det involverer 'riboswitches' fra bakterielt RNA - vist her som synkroniserede svømmere - og et lille molekyle kaldet adenin (røde kugler). Når de to interagerer, riboswitches vender ind i en dramatisk anden form, og dette ændrer igen formen på de krystaller, de er indlejret i. Undersøgelser som disse, som kun kan udføres ved røntgenfri elektronelasere, åbne en vej til at forstå, hvordan RNA og andre komplekse biomolekyler fungerer, og i sidste ende at udvikle behandlinger for sygdom. Kredit:Joseph Meyer/Frederick National Laboratory for Cancer Research
Forskere har brugt den kraftfulde røntgenlaser ved Department of Energy's SLAC National Accelerator Laboratory til at lave de første øjebliksbilleder af en kemisk interaktion mellem to biomolekyler - en der vender en RNA "switch", der regulerer produktion af proteiner, livets arbejdshestmolekyler.
Resultaterne, udgivet i dag i Natur , vise potentialet for spilændrende røntgenfri-elektronlasere, eller XFEL'er, for at studere RNA, som styrer proteinfremstilling i cellen, fungerer som det primære genetiske materiale i retrovira såsom HIV og spiller også en rolle i de fleste former for kræft.
Og fordi denne særlige type RNA -switch, kendt som en riboswitch, findes kun i bakterier, en dybere forståelse af dets funktion kan tilbyde en måde at slukke proteinproduktion og dræbe skadelige bakterier uden at forårsage bivirkninger hos de mennesker, de inficerer.
"Tidligere eksperimenter med SLACs røntgenlaser har undersøgt biologiske reaktioner som fotosyntese, der udløses af lys. Men dette er det første, der observerer et, der udløses af den kemiske interaktion mellem to biomolekyler i realtid og i atomskala, "sagde Yun-Xing Wang, en strukturbiolog ved National Cancer Institute's Center for Cancer Research, der ledede det internationale forskerteam.
"Dette viser virkelig den unikke evne, som røntgenfri-elektronlasere tilbyder, at ingen aktuel teknologi, eller enhver anden teknologi i horisonten, kan gøre. Det er som om du har et kamera med en meget hurtig lukkerhastighed, så du kan fange alle bevægelser af biomolekylerne i aktion. "
Eksperimenterne blev udført ved SLAC's Linac Coherent Light Source (LCLS), en DOE Office of Science brugerfacilitet. De er de første til at demonstrere, hvordan XFEL'er kan tage snapshots og potentielt lave film af RNA og andre biomolekyler, når de kemisk interagerer - og giver glimt af grundlæggende funktioner i cellen, som ikke kan opnås på anden måde.
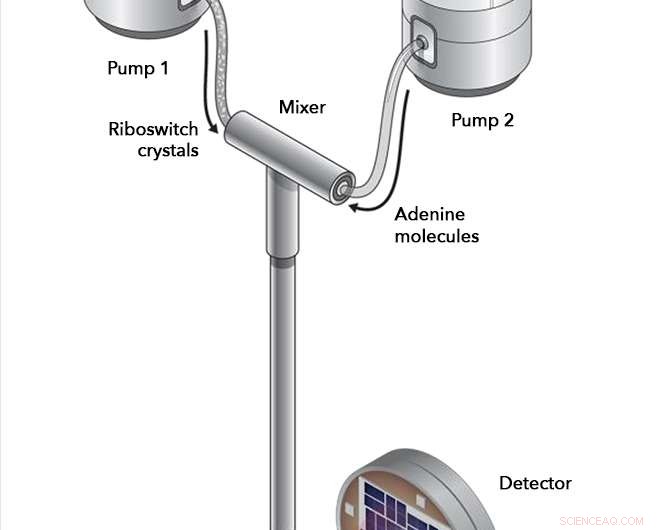
I forsøg med SLACs Linac kohærente lyskilde, riboswitch -krystaller og adeninmolekyler blev pumpet ind i et blandingskammer, hvor de fik lov til at interagere i omhyggeligt tidsbestemte intervaller, inden de blev injiceret i røntgenlaserstrålens vej. Røntgenstrålene sprang af riboswitch-molekylerne og ind i en detektor, registrering af eventuelle ændringer i riboswitch -strukturen, der fandt sted. Kredit:Joseph Meyer/National Cancer Institute
Ser RNA Shape Shifting
RNA er en vigtig del af det genetiske materiale i alle levende celler. Det findes i flere typer, der arbejder sammen om at styre produktionen af proteiner ved cellens ribosomer, ifølge blueprints kodet i DNA.
Men både DNA og RNA indeholder også omfattende regioner, der ikke koder for noget protein - det såkaldte genetiske "mørke stof". Forskere troede i mange år, at disse regioner ikke gjorde noget. Nu ved de, at de spiller en vigtig rolle i at bestemme, hvor og hvornår gener tænder og slukker og ellers finjusterer deres funktion. Langt de fleste kræftformer skyldes mutationer i disse ikke-kodende regioner, Wang sagde, så forståelse for, hvordan disse regioner fungerer, er vigtig for kræftforskning samt grundlæggende biologi.
Imidlertid, at finde ud af, hvad RNA-ikke-kodende regioner gør, er svært. RNA -molekyler er vaklende og fleksible, så det er svært at inkorporere dem i de store krystaller, der typisk er nødvendige for at studere deres atomstruktur ved røntgenlyskilder.
LCLS fjerner denne barriere ved at lade forskere få strukturel information fra meget mindre, nanoserede krystaller, som er meget lettere at lave. Dens kraftfulde røntgenlaserpulser, en milliard gange lysere end nogen tidligere tilgængelig, er så korte, at de indsamler data fra hver krystal i et par milliontedele af en milliarddel af et sekund, før skader fra røntgenstrålerne indtræder.
Wangs team studerede en riboswitch fra Vibrio vulnificus, en bakterie relateret til den, der forårsager kolera. Riboswitch sidder i en lang streng af messenger RNA (mRNA), som kopierer DNA's instruktioner til fremstilling af et protein, så de kan læses og udføres af ribosomet. Omskifteren fungerer som en termostat, der regulerer proteinproduktion.
I dette tilfælde, mRNA styrer produktionen af et protein, der igen hjælper med at producere et lille molekyle kaldet adenin. Når der er for meget adenin i bakteriecellen, adeninmolekyler kommer ind i lommerne i riboswitcherne og vender riboswitchene til en anden form, og dette ændrer tempoet i protein- og adeninproduktion.
Første stillbilleder af en elegant film
Til LCLS -eksperimenterne forskerne lavede nanokrystaller, der inkorporerede millioner af kopier af riboswitch og blandede dem med en opløsning indeholdende adeninmolekyler. Hver krystal var så lille, at adenin hurtigt og ensartet kunne trænge ind i hvert hjørne af den, indtast riboswitch -lommer og vend dem næsten øjeblikkeligt, som om de var millioner af synkroniserede svømmere, der udførte et enkelt fejlfrit træk.
Forskerne tog øjebliksbilleder af denne interaktion ved at ramme krystallerne med røntgenlaserpulser med omhyggeligt tidsintervaller efter blandingen startede. Dette gav dem det første glimt af et flygtigt mellemtrin i processen, som fandt sted 10 sekunder i. Separat, de fik de første billeder af riboswitchen i sin initial, tilstand med tom lomme, og opdagede, at den fandtes i to lidt forskellige konfigurationer, kun den ene deltager i skiftet.
Forskerne blev overraskede over at opdage, at den pludselige ændring i riboswitches form var så dramatisk, at den ændrede formen på hele krystallen, også. Normalt ville en større ændring som denne knække krystallen og ødelægge eksperimentet. Men fordi disse krystaller var så små, holdt de sammen, så røntgenlaseren kan stadig få strukturel information fra dem.
"For mig er det stadig et mysterium, hvordan krystallen formåede at gøre det, "sagde Soichi Wakatsuki, en professor ved SLAC og ved Stanford School of Medicine og leder af laboratoriets afdeling for biovidenskab, der ikke var en del af forskerholdet. "Dette åbner faktisk en masse nye muligheder og giver os en ny måde at se på, hvordan RNA og proteiner interagerer med små molekyler, så det er meget spændende. "
 Varme artikler
Varme artikler
-
 Forskning skaber nye muligheder for at designe nye materialer med mærkelige og eksotiske egenskaberSnapshot af den hexatiske fase i 2D harddiske. Kredit:University of Bristol Nobelprisen i fysik i 2016 fejrede den rige opførsel af todimensionale (2-D) materialer, som atomer, molekyler, eller el
Forskning skaber nye muligheder for at designe nye materialer med mærkelige og eksotiske egenskaberSnapshot af den hexatiske fase i 2D harddiske. Kredit:University of Bristol Nobelprisen i fysik i 2016 fejrede den rige opførsel af todimensionale (2-D) materialer, som atomer, molekyler, eller el -
 Forskere udfordrer vores antagelser om virkningerne af planetarisk rotationEt 2D-billede af hastigheden i en intern stråle med Rossby-tallet på 100, der viser, hvordan planetarisk rotation fører til destabilisering og spredning af et oprindeligt sammenhængende strømningsmøns
Forskere udfordrer vores antagelser om virkningerne af planetarisk rotationEt 2D-billede af hastigheden i en intern stråle med Rossby-tallet på 100, der viser, hvordan planetarisk rotation fører til destabilisering og spredning af et oprindeligt sammenhængende strømningsmøns -
 Typer af højt trykkedlerEn kedel er et fartøj, hvor vand opvarmes under tryk og fordampes til damp til et bestemt formål. Der er flere forskellige slags kedler, opvarmet af kul, fast brændsel, olie eller gas. Kedler varierer
Typer af højt trykkedlerEn kedel er et fartøj, hvor vand opvarmes under tryk og fordampes til damp til et bestemt formål. Der er flere forskellige slags kedler, opvarmet af kul, fast brændsel, olie eller gas. Kedler varierer -
 Forskere demonstrerer eksistensen af en ny form for magnetoresistens, der involverer topologiske i…Den skematiske figur illustrerer konceptet og adfærden ved magnetoresistens. Spins genereres i topologiske isolatorer. Dem i grænsefladen mellem ferromagnet og topologiske isolatorer interagerer med f
Forskere demonstrerer eksistensen af en ny form for magnetoresistens, der involverer topologiske i…Den skematiske figur illustrerer konceptet og adfærden ved magnetoresistens. Spins genereres i topologiske isolatorer. Dem i grænsefladen mellem ferromagnet og topologiske isolatorer interagerer med f
- Forskning finder en dramatisk stigning i vildtlevende rovdyr, da brande gør nogle indfødte austral…
- Tørstige protester ramte Marokko over vandmangel
- Forskere dyrker carbon nanofibre ved hjælp af omgivende luft, uden giftig ammoniak
- Hvad er BPA,
- Udvikling af grafentransistor med nyt driftsprincip
- Mine briller har en antireflekterende belægning. Hvordan fungerer det?


