For første gang, forskere måler vandets egenskaber ved dybt underafkølede temperaturer

Vand er i modsætning til andre stoffer, fordi dets faste form - som dette isbjerg - er mindre tæt end dens flydende form - som dette hav. Forskere studerer andre mærkelige egenskaber ved vand. Kredit:Wikimedia Commons
Vand har mange usædvanlige egenskaber, såsom dens faste form, is, at kunne flyde i flydende vand, og de bliver underligere under dens frysepunkt. Overkølet vand - under frysepunktet, men stadig en væske - er notorisk svært at undersøge. Nogle forskere syntes, at underkølet vand opførte sig mærkeligt inden for et særligt koldt område, snapper fra en væske til et fast stof, øjeblikkeligt krystalliserer ved en bestemt temperatur som noget ud af en Kurt Vonnegut -roman.
Nu, forskere har fundet ud af en måde at tage øjebliksbilleder af frysning af vand inden for det dybt underkølede område. Og gæt hvad? Vand er ikke så underligt, som det kunne være. Flydende vand kan eksistere helt ned, krystalliserer til et faststof langsommere, når tingene bliver koldere - som forventet, men aldrig på én gang.
Et team af forskere fra Department of Energy's Pacific Northwest National Laboratory rapporterede om arbejdet i denne uges Procedurer fra National Academy of Sciences Tidlig udgave online. Selvom resultaterne ikke ændrer måden du laver din iste på om sommeren, det kan hjælpe teoretikere med at uddybe deres forståelse af vand og hjælpe atmosfæriske forskere med bedre at forstå regn og skyer.
Et underligt vandtrick
De fleste ved, at is flyder på flydende vand, men de er måske ikke klar over, at vand har svært ved at danne et glas. Et glas - som et vindue - er et fast stof, hvor molekylerne faktisk er arrangeret, som de ville være i en væske.
Tag en flok appelsiner. Appelsiner blandet løst i en pose er som en væske - de enkelte molekyler kan bevæge sig ret frit. Hvis du pakker appelsinerne pænt i en æske, du danner en krystal. Hvis du strammer posen og stopper de blandede appelsiner fra at bevæge sig rundt, men uden at ordne dem pænt, du danner et glas.
Briller er gode, fordi de kan indeholde forurenende stoffer - tænk en flue i rav, eller atomaffald i forglaset glas - mens krystaller sparker forurenende stoffer ud - frysning af havvand er en måde at afsaltes på. For at lave et glas, forskere smelter sand eller en anden komponent, indtil det er flydende. Og så afkøler de det så hurtigt, at det ikke kan danne en krystal, før det størkner.
Men frys bulkvand hurtigt, og det danner ikke et glas. Det bliver hurtigt til is. For at blive til glas, flydende vand skal afkøles til en dybt nul temperatur inden for mikrosekunder - cirka 136 Kelvin (ca. minus 215 grader F), en almindelig temperatur i det ydre rum, hvor nogle forventer, at der findes glasagtigt vand.
Det område, der har været svært at studere, ligger lidt over den såkaldte glasovergangstemperatur. Forskere ved ikke, hvad der foregår mellem omkring 160 og 235 K. (I virkeligheden, det er mellem temperaturen på Mars måne Phobos og Fairbanks, Alaska, i dybden af vinteren.) I den høje ende af dette område (tættere på 235 K, Fairbanks), vand fryser fra en afkølet væske til en krystal i millisekunder, hvilket er alt for hurtigt til at studere nuværende analytiske teknikker.
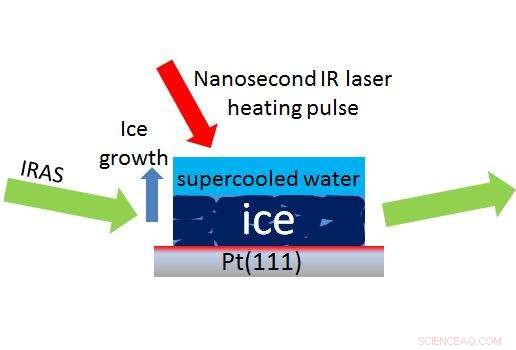
En laser (rød pil) skaber en lille dråbe afkølet vand over is, tillader forskere at bruge en metode kaldet IRAS (grønne pile) til at måle i nanosekunder, hvor hurtigt superkølet vand vender tilbage til is. Kredit:Kay, Kimmel/PNNL
Forskere kom med en række forskellige ideer til at forklare, hvad der kunne ske i den uudforskede region. De spekulerede på, om vandet ville forblive metastabilt - flydende men klar til at begynde at krystallisere med et øjebliks varsel - helt ned til temperaturer, hvor det bliver til et glas. Eller hvis væsken ville blive ustabil et eller andet sted varmere end det, omkring 228 K (lidt varmere end rekorden lav på McMurdo Station i Antarktis), på hvilket tidspunkt ville det spontant krystallisere på grund af det fysikere kalder en singularitet. Også, noget inden for dette område kan ske, der kan hjælpe med at forklare, hvorfor vand har svært ved at danne et glas.
"Der var en overflod af postulater, men en mangel på data, "sagde PNNL kemisk fysiker Bruce Kay.
"Vores mål var at udvikle en ny teknik til hurtigt at opvarme og afkøle superkølede vandfilm i nanoskala, "sagde PNNL -fysikeren Greg Kimmel.
Mysteriet indeni
For at få dataene i det umålelige område, Kimmel og Kay arbejdede sammen med Yuntao Xu, en laserekspert og andre på PNNL og udviklede en måde at opvarme og afkøle vand på nanosekunders tidsskalaer med en laser. Ved hjælp af denne metode, PNNL -forskerne målte, hvor hurtigt det afkølede vand konverterede til krystallinsk is, efterhånden som temperaturen faldt. Krystalliseringstiden faldt fra nanosekunder nær de højeste temperaturer til timer ved 126 K. På intet tidspunkt, især ved 228 K, slog det afkølede vand ind i en krystal, udelukke muligheden for en singularitet.
At lede efter singulariteten fra en anden vinkel, forskerne undersøgte, hvor hurtigt molekylerne i afkølet vand kunne bevæge sig, og hvor meget det ændrede sig, da det blev koldere. Hvis singulariteten eksisterede, de ville forvente, at vandmolekylerne ikke kunne bevæge sig på et tidspunkt. Fra frysepunktet til glaspunktet, molekylerne bevægede sig langsommere og langsommere på en kompleks, men kontinuerlig måde. Samlet set, forholdet mellem temperaturen og hvor hurtigt molekylerne kunne bevæge sig, tyder ikke på en singularitet ved 228 K.
"Vi kan nok tage singulariteten fra bordet, "sagde PNNL's Kay.
Taget sammen, resultaterne giver værdifuld indsigt i, hvordan vand opfører sig.
"For eksempel, i atmosfærisk kemi, overkølede dråber vand findes i skyer. Der er spørgsmål om, hvor længe de holder ved, "sagde PNNL's Kimmel.
Sidste artikelOptisk traktorstråle fanger bakterier
Næste artikelFørste måling af flow -reversering af negative ioner
 Varme artikler
Varme artikler
-
 Kollektive orme- og robotklatter beskytter individer, sværme sammenStore grupper af californiske sortorme danner ormeklatter, der skaber kollektiv adfærd, der forbedrer overlevelsen af individuelle organismer. Kredit:Christopher Moore, Georgia Tech Individuelt,
Kollektive orme- og robotklatter beskytter individer, sværme sammenStore grupper af californiske sortorme danner ormeklatter, der skaber kollektiv adfærd, der forbedrer overlevelsen af individuelle organismer. Kredit:Christopher Moore, Georgia Tech Individuelt, -
 Minitornadoer af sporer belyst under regndråberBillede af luft-hvirvelspredning af plantepatogen. We -værdien repræsenterer slagets hastighed og overfladespænding af vand. Foto med tilladelse til Hyunggon Park. Kredit:Virginia Tech Plantsygdom
Minitornadoer af sporer belyst under regndråberBillede af luft-hvirvelspredning af plantepatogen. We -værdien repræsenterer slagets hastighed og overfladespænding af vand. Foto med tilladelse til Hyunggon Park. Kredit:Virginia Tech Plantsygdom -
 Globalt team af forskere er færdige med at samle næste generations detektor for mørkt stofForskere undersøger den folieindpakket LUX-ZEPLIN xenon-detektor. Kredit:Matt Kapust Nøglekomponenten i LUX-ZEPLIN-eksperimentet er klar til at blive forseglet og sænket næsten 1,5 km under jorden
Globalt team af forskere er færdige med at samle næste generations detektor for mørkt stofForskere undersøger den folieindpakket LUX-ZEPLIN xenon-detektor. Kredit:Matt Kapust Nøglekomponenten i LUX-ZEPLIN-eksperimentet er klar til at blive forseglet og sænket næsten 1,5 km under jorden -
 Styring af elektroner og vibrationer i en krystal med polariseret lysKredit:Tokyo Institute of Technology Kvanteadfærden af atomare vibrationer exciteret i en krystal ved hjælp af lysimpulser har meget at gøre med polariseringen af impulserne, siger materialefo
Styring af elektroner og vibrationer i en krystal med polariseret lysKredit:Tokyo Institute of Technology Kvanteadfærden af atomare vibrationer exciteret i en krystal ved hjælp af lysimpulser har meget at gøre med polariseringen af impulserne, siger materialefo
- Spørgsmål og svar:Trump, posthuset og Amazon
- Omgivet af potentiale:Ny videnskab i omdannelse af biomasse
- Assistance i de første år af en biologifag fører til højere fastholdelse af førstegenerationsst…
- Eksistentialisme:En ledende filosofi til håndtering af klimaændringer i byer?
- 2-D oxidflager opfanger overraskende elektriske egenskaber
- Gendannelse af kulturelt relevante fødevaresystemer til indianer- og immigrantbefolkninger


