Når proteiner bejler til hinanden, dansebevægelserne betyder noget
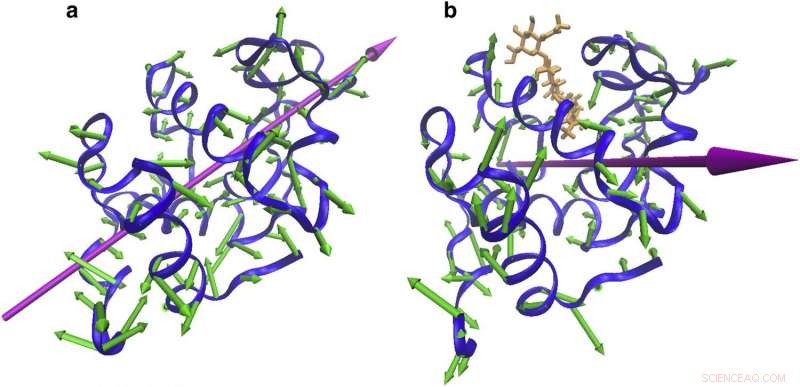
Ændringer i vibrationsretning med binding. Proteinvibrationer, der indikerer (a) en klemmebevægelse omkring bindingsstedet ved 55 cm?1 fra NMA af fri CEWL og (b) en vridning omkring bindingsstedet. Kredit:Genoptrykt med tilladelse fra Biophysical Journal.
Hvert øjeblik inde i den menneskelige krop, en omhyggeligt koreograferet dans bliver opført.
Proteiner ryster deres kroppe og vifter med deres lemmer, alt sammen med det mål at optimere deres interaktion med andre molekyler, inklusive andre proteiner. Disse små bevægelser, kaldet vibrationer, gøre det muligt for molekylerne at ændre form hurtigt for at binde sig til hinanden, hvilket igen letter opgaver som at optage ilt og reparere celler.
Kroppens effektivitet til at udføre disse funktioner afhænger af, hvor godt proteiner kan interagere.
Men hvad gør et protein til en bedre bejler end et andet?
En ny undersøgelse belyser dette spørgsmål, viser, at i dette biologiske frieri, dansebevægelser betyder noget.
"I fortiden, forskning i proteinvibrationer fokuserede meget på energien af disse vibrationer, " siger ledende videnskabsmand Andrea Markelz, Ph.d., en professor i fysik ved universitetet ved Buffalo College of Arts and Sciences. "Men det, vi fandt, er, at bevægelsesretningen ser ud til at have større betydning. Bevægelsesretningen - den retning, som forskellige dele af proteinet bevæger sig i - kan virkelig bestemme, hvor godt et protein udfører sin biologiske funktion."
Resultaterne er med til at lægge et fundament for udviklingen af lægemidler rettet mod molekylære vibrationer. Sådanne lægemidler ville blokere proteiner i at udføre opgaver, der bidrager til sygdom.
"Vi udførte forskningen ved hjælp af en ny teknik, vi udviklede kaldet anisotropisk terahertz-mikroskopi (ATM), som afslører, hvordan naturen udnytter proteinbevægelser til at forbedre effektiviteten. Vi kan så optimere disse bevægelser til medicin og bioteknologi, " siger førsteforfatter Katherine Niessen, en UB-ph.d.-kandidat i fysik.
Forskningen, udgivet den 14. marts i Biofysisk tidsskrift , blev udført af UB, universitetet i Perugia i Italien, og Hauptman-Woodward Medical Research Institute. Det blev finansieret af National Science Foundation (NSF).
Foxtrot eller tango?
Undersøgelsen fokuserede på hønseæggehvidelysozymet, et protein, der findes i æggehvider.
Som et første skridt i deres projekt, forskerne sammenlignede lysozymets regelmæssige vibrationer med lysozymets vibrationer, når det var bundet til et molekyle, hvis tilstedeværelse blokerede proteinet i at udføre dets sædvanlige biologiske pligter.
Hvad forskerne så var, at de frie og hæmmede lysozymer vibrerede ved lignende energier, men med distinkte bevægelsesretninger:Det frie lysozym flagrede med en hængsellignende flagrende handling – som en sommerfugls vinger – mens det hæmmede lysozym bevægede sig i et mere sakseagtigt mønster.
"Resultatet var en fundamental ændring i forhold til den konventionelle opfattelse. Vibrationerne ændrede deres retning, selvom energien i bevægelserne forblev den samme, " siger Markelz. (Hun tilføjer, at som en analogi, dette er beslægtet med to mennesker, der udfører forskellige danse - foxtrot og tango, for eksempel - men udøver den samme mængde energi.)
Den samme dynamik opstod, da holdet sammenlignede det almindelige lysozym med et mutant hønseæggehvidelysozym, der var mere effektivt til at udføre sit job. De mutante og normale lysozymer havde de samme vibrationsenergier, men forskellige vibrationsretninger.
Et nøglefærdigt instrument til måling af vibrationer
Forskning i molekylære vibrationer kan åbne nye veje for udvikling af lægemidler og kunstig energihøst (vibrationerne kan forklare, hvorfor fotosyntese er så effektiv). Men historisk set, de små pulser og hjertebanken i proteiner har været meget svære at studere.
Markelz håber at ændre det ved at udvikle et nøglefærdigt instrument, som videnskabsmænd over hele verden kan bruge til at forske i vibrationerne.
For at studere hønseæggehvidelysozymet, hendes team brugte ATM-teknikken, som hendes forskergruppe udviklede internt. I modsætning til andre metoder, der bruges til at forske i proteinvibrationer, ATM gør det muligt for forskere at observere ikke kun vibrationsenergier, men også bevægelsesretningen.
NSF tildelte for nylig Markelz en næsten $400, 000 tilskud til kommercialisering af et letanvendeligt ATM-instrument, hvilket ville udvide det videnskabelige samfunds kapacitet til at udforske molekylære vibrationer. Enheden ville repræsentere et stort fremskridt i forhold til andre eksisterende metoder, som kun giver et groft overblik over vibrationerne og kræver ekstremt tørre og kolde miljøer og dyre faciliteter, siger Markelz.
 Varme artikler
Varme artikler
-
 Fysikken i ægdråpsvidenskabsprojekterÆggedråpseksperimentet - et videnskabsprojekt, hvor studerende skaber måder at forhindre et æg i at bryde, når det falder fra en bestemt højde - er et højdepunkt i de fleste fysikklasser. Læs videre f
Fysikken i ægdråpsvidenskabsprojekterÆggedråpseksperimentet - et videnskabsprojekt, hvor studerende skaber måder at forhindre et æg i at bryde, når det falder fra en bestemt højde - er et højdepunkt i de fleste fysikklasser. Læs videre f -
 Generering af elektrisk strøm fra spildvarmeDenne lille silicium-baserede enhed udviklet på Sandia National Laboratories kan fange og konvertere spildvarme til elektrisk strøm. Rektenna, kort til ensretter antenne, er lavet af almindeligt alumi
Generering af elektrisk strøm fra spildvarmeDenne lille silicium-baserede enhed udviklet på Sandia National Laboratories kan fange og konvertere spildvarme til elektrisk strøm. Rektenna, kort til ensretter antenne, er lavet af almindeligt alumi -
 Belysning af uønskede urenheders rolle i galliumnitrid-halvledereKulstofurenheder i galliumnitrid (GaN) halvledere påvirker GaN krystalvækst og forringer deres ydeevne. Kredit:Masashi Kato fra Nagoya Institute of Technology Halvlederindustrien og stort set al e
Belysning af uønskede urenheders rolle i galliumnitrid-halvledereKulstofurenheder i galliumnitrid (GaN) halvledere påvirker GaN krystalvækst og forringer deres ydeevne. Kredit:Masashi Kato fra Nagoya Institute of Technology Halvlederindustrien og stort set al e -
 En fjernbetjening til alt det lilleIntensitetsfordeling af et elektrisk bølgefelt, der anvender et veldefineret drejningsmoment på det kvadratiske mål. Kredit:TU Wien Atomer, molekyler eller endda levende celler kan manipuleres med
En fjernbetjening til alt det lilleIntensitetsfordeling af et elektrisk bølgefelt, der anvender et veldefineret drejningsmoment på det kvadratiske mål. Kredit:TU Wien Atomer, molekyler eller endda levende celler kan manipuleres med
- Hvad Facebook ikke fortæller os om sin kamp mod onlinemisbrug
- Rusland sender nyt mandskab til ISS på hurtig rejse
- DJ skal være den første sorte afrikaner i rummet, der blev dræbt i cykelulykke
- Dyr i den tropiske ørken
- Sikkerhedsforanstaltninger ved brug af en pipette
- Næringsstofgenbrugsmikrober kan føle varmen


