Nye algoritmer udtrækker biologisk struktur fra begrænsede data
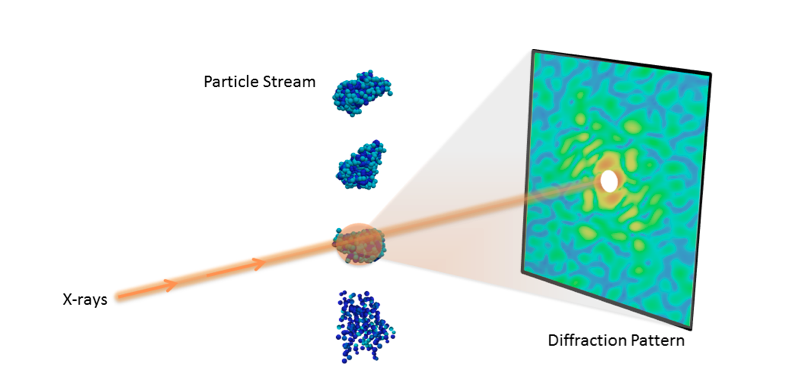
Eksperimentel opsætning af et enkeltpartikel diffraktionseksperiment. Kredit:Peter Zwart, Berkeley Lab
At forstå 3D -molekylstrukturen for vigtige nanoobjekter som proteiner og vira er afgørende inden for biologi og medicin. Med de seneste fremskridt inden for røntgenteknologi, forskere kan nu indsamle diffraktionsbilleder fra individuelle partikler, i sidste ende tillader forskere at visualisere molekyler ved stuetemperatur.
Imidlertid, bestemmelse af 3D-struktur ud fra disse enkeltpartikel diffraktionsforsøg er en betydelig hindring. For eksempel, nuværende dataindsamlingshastigheder er meget begrænsende, typisk resulterer i færre end 10 nyttige snapshots i minuttet, begrænsning af mængden af funktioner, der kan løses. Derudover billederne er ofte stærkt ødelagte med støj og andre eksperimentelle artefakter, gør det svært at tolke dataene korrekt.
For at imødekomme disse udfordringer, et team af forskere fra Lawrence Berkeley National Laboratory (Berkeley Lab) har udviklet en ny algoritmisk ramme kaldet multi-tiered iterative phasing (M-TIP), der anvender avancerede matematiske teknikker til at bestemme 3D molekylær struktur fra meget sparsomme sæt støjende, enkeltpartikeldata. Denne tilgang giver i det væsentlige forskere mulighed for at udtrække mere information fra eksperimenter med begrænsede data. Anvendte matematikere Jeffrey Donatelli og James Sethian, og fysisk bioscientist Peter Zwart introducerede denne ramme ved at udvide på en algoritme, som de oprindeligt udviklede til at løse rekonstruktionen fra et beslægtet røntgenspredningseksperiment, kaldes fluktuationsrøntgenstråling. Et papir, der beskriver M-TIP-rammen, blev offentliggjort den 26. juni i Procedurer fra National Academy of Sciences .
"Denne tilgang har potentiale til at revolutionere feltet, "siger Zwart." I betragtning af at det er svært at få mange gode data, tilgange, der reducerer mængden af data, der er nødvendige for at kunne billedføre 3D -nanoobjekter, vil sandsynligvis modtage en varm velkomst. "
Donatelli, Sethian og Zwart er alle en del af CAMERA (The Center for Advanced Mathematics for Energy Research Applications), hvis mission er at skabe den topmoderne matematik, der kræves for at håndtere data fra mange af DOEs mest avancerede videnskabelige faciliteter. CAMERA finansieres i fællesskab af programmerne Advanced Scientific Computing Research og Basic Energy Sciences i DOE's Office of Science.
Enkeltpartikeldiffraktion
Den nylige fremkomst af røntgenfrielektronlasere (XFEL'er) har muliggjort flere nye eksperimentelle teknikker til at studere biomolekyler, der var umulige med traditionelle lyskilder. En sådan teknik er enkeltpartikeldiffraktion, som samler et stort antal røntgendiffraktions-snapshots med kun en enkelt partikel i strålen. Ved at udnytte XFEL'ernes ekstreme kraft, forskere kan indsamle målbare signaler selv fra de mindste partikler.
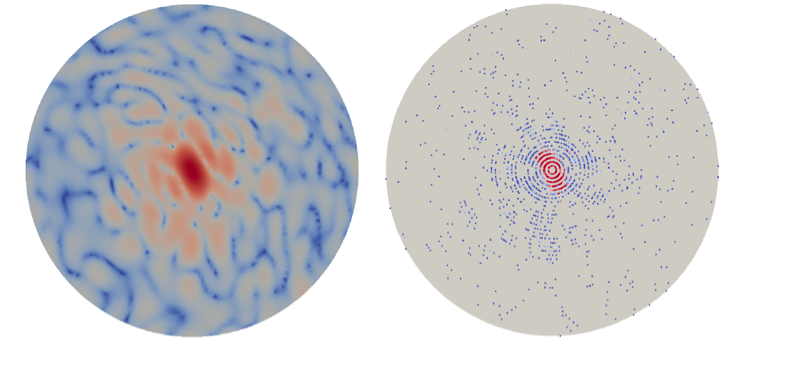
Et eksempel på et rent enkeltpartikel diffraktionsbillede (venstre) og det samme diffraktionsbillede efter støjforurening (højre). Kredit:Peter Zwart, Berkeley Lab
En stor fordel ved denne enkeltpartikel-diffraktionsteknik er evnen til at studere, hvordan forskellige kopier af et molekyle varierer eller ændrer form. Da hvert billede stammer fra en enkelt partikel, disse variationer kan fanges i forsøget, i modsætning til traditionelle billeddannelsesmetoder som krystallografi eller lillevinklet røntgenstråling, hvor forskere kun kan måle et gennemsnit over alle forskellige tilstande i molekylprøven.
Imidlertid, at bestemme 3D-strukturen ud fra enkeltpartikeldiffraktionsdata er udfordrende. At begynde, når hver partikel er afbildet, dets orientering er ukendt og skal genoprettes for korrekt at kunne kombinere dataene til et 3D -diffraktionsvolumen. Dette problem forværres, hvis molekylet kan antage forskellige former, hvilket kræver yderligere klassificering af billederne. Desuden, faseinformation registreres ikke i diffraktionsbilleder og skal gendannes for at fuldføre rekonstruktionen. Endelig, selv med kraftfulde XFEL'er, antallet af spredte fotoner er meget lille, resulterer i ekstremt støjende billeder, som kan blive yderligere forurenet af systematiske baggrunds- og detektorudlæsningsproblemer.
Tidligere tilgange er baseret på at løse genopbygningsproblemet i separate trin, hvor hvert enkelt problem behandles separat. Desværre, en ulempe ved disse serielle tilgange er, at de ikke let udnytter tidligere kendte funktioner om, hvordan molekylet ser ud. Ud over, enhver fejl begået i et trin overføres til det næste, hvilket resulterer i en yderligere stigning i fejl. Denne "fejlsnebold" forringer i sidste ende kvaliteten af den rekonstruktion, der blev opnået i det sidste trin.
Bedst af begge verdener
I stedet for at løse beregningsproblemerne i separate trin, teamets M-TIP-algoritme løser alle dele af problemet samtidigt. Denne fremgangsmåde udnytter tidligere oplysninger om strukturen for i høj grad at reducere problemets frihedsgrader i alle trin, og dermed reducere den nødvendige information for at opnå en 3D -rekonstruktion.
"Standard black-box optimeringsteknikker kan inkorporere forudgående viden i genopbygningen, men smider hele problemets struktur, der henviser til, at løsningen i helt separate serielle deltrin udnytter problemets struktur, men smider næsten alle forudgående oplysninger om, hvordan løsningen kan se ud, "Sagde Donatelli." M-TIP udnytter det bedste fra begge verdener ved at udnytte problemets struktur til at opdele beregningen i flere håndterbare bidder og derefter iterativt forfine over alle disse bidder for at nå frem til en løsning, der er i overensstemmelse med begge data og eventuelle strukturelle begrænsninger. "
Ved hjælp af denne teknik, teamet var i stand til at bestemme 3D -struktur ud fra ekstremt lave billedtællinger fra simulerede data, så lavt som 6 til 24 billeder til støjfrie data og 192 billeder fra stærkt forurenede data.
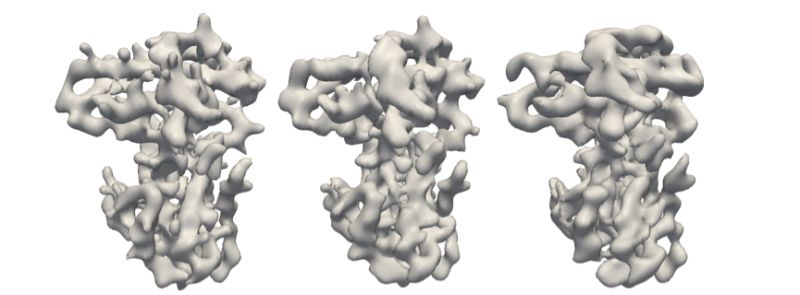
Originalt retinoblastomprotein (til venstre) og rekonstruktioner ved hjælp af M-TIP-algoritmen med 24 rene billeder (i midten) og 192 støjende billeder (til højre), som vist i figur 2. Kredit:Peter Zwart, Berkeley Lab
Bryder ny jord
Dette arbejde er en del af et nyt samarbejde mellem SLAC National Accelerator Laboratory, KAMERA, National Energy Research Scientific Computing Center (NERSC) og Los Alamos National Laboratory som en del af DOE's Exascale Computing Project (ECP). Målet med projektet er at udvikle de beregningsværktøjer, der er nødvendige for at udføre dataanalyse i realtid fra forsøg udført på SLACs Linac Coherent Light Source (LCLS). Med opgraderinger til bjælkelinjen, LCLS-II planlægger at generere flere terabyte data pr. Sekund, hvilken, for eksempel, vil give forskere mulighed for i høj grad at udvide på nuværende enkeltpartikelforsøg. At analysere alle disse data i realtid vil kræve nye algoritmer og store computermaskiner. M-TIP-algoritmen fungerer som en del af denne proces.
"Dette er nogle af de mest udfordrende problemer inden for beregningsdatavidenskab, "siger Sethian." For at tackle dem, vi har brug for at udnytte en række teknologier, herunder nye exascale computingarkitekturer, sofistikerede højhastighedsnetværk, og de mest avancerede matematiske algoritmer til rådighed. At bringe CAMERA -forskere sammen med exascale applikationsprojekter har åbnet døren for at bygge værktøjer til at gribe nogle presserende problemer inden for biologi og materialevidenskab. "
Forskerne bemærker, at dette kun er de første trin. For at metoden er klar til at blive indsat, andre forhindringer skal overvindes.
"Eksperimentel videnskab er rodet, "siger Zwart." Der er yderligere eksperimentelle effekter, der skal tages i betragtning for at vi kan få de bedst mulige resultater. "
"Heldigvis, M-TIP er en meget modulær teknik, "tilføjer Donatelli, "så, det er velegnet til at modellere mange af disse yderligere effekter uden at skulle ændre den grundlæggende algoritmiske ramme. "
Teamet arbejder i øjeblikket på at studere disse effekter som en del af Single Particle Initiative, en stor, multiinstitutionelt samarbejde dedikeret til at behandle teoretiske og praktiske spørgsmål inden for X-FEL-baseret enkeltmolekylebilleddannelse, i sidste ende fører til at give det videnskabelige samfund de værktøjer, der er nødvendige for at bryde nye veje inden for biologi, medicin og energifag.
 Varme artikler
Varme artikler
-
 Frit diffuserende cellulære proteiner når forkanten hurtigereKredit:Kara / Fotolia.com Ifølge en teoretisk model udviklet af LMU-fysikere, i cellefremspring, lasttransporterende motorproteiner kommer ofte i vejen for hinanden. Resultatet er, at frit diffuse
Frit diffuserende cellulære proteiner når forkanten hurtigereKredit:Kara / Fotolia.com Ifølge en teoretisk model udviklet af LMU-fysikere, i cellefremspring, lasttransporterende motorproteiner kommer ofte i vejen for hinanden. Resultatet er, at frit diffuse -
 Nucleus-specifik røntgenfarvning til 3-D virtuel histologiRøntgen egnet, kernespecifik farvningsmiddelprotokol til 3D virtuel histologi. Farvningsprotokol og interaktion af den hæmatein-baserede røntgenfarvning med blødt væv. (A) Den udviklede hæmatein-baser
Nucleus-specifik røntgenfarvning til 3-D virtuel histologiRøntgen egnet, kernespecifik farvningsmiddelprotokol til 3D virtuel histologi. Farvningsprotokol og interaktion af den hæmatein-baserede røntgenfarvning med blødt væv. (A) Den udviklede hæmatein-baser -
 Forskere modellerer fotoluminescenskinetik i halvleder nanoplader for bedre optoelektronikKredit:CC0 Public Domain Forskere fra Skoltech og deres kolleger har bygget to modeller, der præcist forklarer den lysemitterende adfærd af halvleder nanoplader, små strukturer, der kan blive bygg
Forskere modellerer fotoluminescenskinetik i halvleder nanoplader for bedre optoelektronikKredit:CC0 Public Domain Forskere fra Skoltech og deres kolleger har bygget to modeller, der præcist forklarer den lysemitterende adfærd af halvleder nanoplader, små strukturer, der kan blive bygg -
 Optisk kohærens tomografi i høj opløsning uden partikelacceleratorSilvio Fuchs i et laboratorium ved Institute of Optics and Quantum Electronics ved Friedrich Schiller University Jena. Kredit:Jan-Peter Kasper/FSU Jena Et besøg hos optometrist involverer ofte opt
Optisk kohærens tomografi i høj opløsning uden partikelacceleratorSilvio Fuchs i et laboratorium ved Institute of Optics and Quantum Electronics ved Friedrich Schiller University Jena. Kredit:Jan-Peter Kasper/FSU Jena Et besøg hos optometrist involverer ofte opt
- Formel for volumen af en hexagon
- Accelererende kvanteteknologier med materialebehandling på atomær skala
- Fra Chelyabinsk til Cuba:Meteorforbindelsen
- Hver transistor har et unikt kvantefingeraftryk - men kan den bruges som en form for ID?
- Ny undersøgelse kaster lys over, hvordan ultralavfrekvente radiobølger og plasma interagerer
- Nye fluorescerende farvestoffer kunne fremme biologisk billeddannelse


