Ser man nærmere på ujævnt ladede biomolekyler
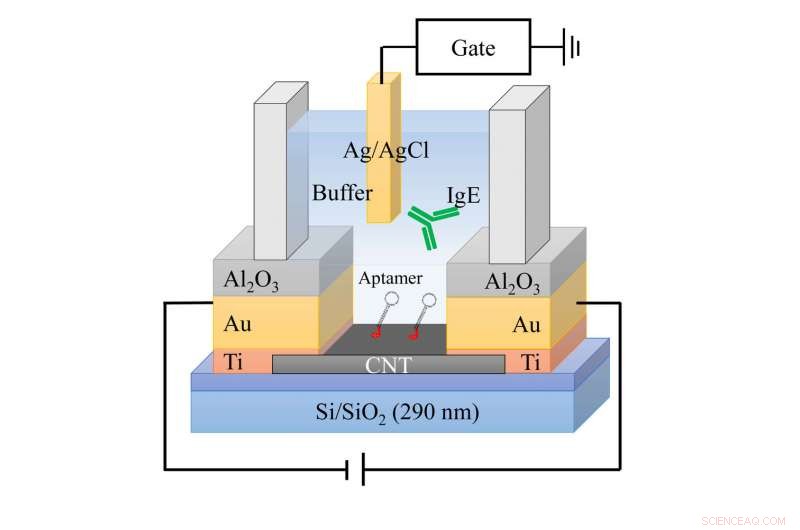
Klinikere overvåger oftest antistoffer, fordi disse små proteiner binder sig til antigener, eller fremmede stoffer, vi står over for hver dag. De fleste biomolekyler, imidlertid, har komplicerede ladningskarakteristika, og sensorresponsen fra konventionelle carbon nanorørsystemer kan være uberegnelig. Et team i Japan afslørede for nylig, hvordan disse systemer fungerer, og foreslog ændringer for dramatisk at forbedre detektering af biomolekyler. De rapporterer deres resultater i Journal of Applied Physics. Dette billede viser en skematisk tegning af sensorenheden ved hjælp af aptamer-modificeret CNT-TFT. Kredit:Ryota Negishi
I klinisk diagnostik, det er afgørende at overvåge biomolekyler på en enkel, hurtig og følsom måde. Klinikere overvåger oftest antistoffer, fordi disse små proteiner binder sig til antigener, eller fremmede stoffer, vi står over for hver dag. De fleste biomolekyler, imidlertid, har komplicerede ladningskarakteristika, og sensorresponsen fra konventionelle carbon nanorørsystemer kan være uberegnelig. Et team i Japan afslørede for nylig, hvordan disse systemer fungerer, og foreslog ændringer for dramatisk at forbedre detektering af biomolekyler. De rapporterer deres fund i Journal of Applied Physics .
Disse forskere demonstrerede en ny teknik til at opdage, måle og analysere biomolekyler med inhomogene ladningsfordelinger ved at justere opløsningen, hvori de overvåger biomolekylet. De brugte carbon nanorør tyndfilmstransistorer (CNT-TFT'er) til at nulstille den nøjagtige mængde af et specifikt biomolekyle i en prøve.
CNT-TFT-biosensorer bruger immunantistofreceptorer kaldet aptamerer til at detektere nettoelektrisk ladning af den del af målmolekylet. Efter at forskere har identificeret et molekyle, et antistof fremstilles for at vedhæfte det i opløsning. Det antistof forbinder derefter til en aptamer på en tynd film af carbon nanorør, der konverterer forbindelsen til et elektrisk signal til sensordetektion. Med dette forbedrede sensorrespons, forskere kan bestemme Debye -længden, eller afstanden mellem en punktladning og molekylet, at kortlægge et molekyls ujævne ladningsfordelinger.
Gruppen opdagede, at de var nødt til at se på, hvordan ladningerne blev fordelt tæt på et molekyls overflade for at forstå den komplicerede adfærd i sensorsignalet. "På trods af at det er det samme målmolekyle, sensorreaktionens polariteter er helt forskellige fra positive eller negative, "sagde Ryota Negishi, en forfatter på papiret.
"Vi opnåede forbedringen af det dynamiske område ved at bruge lav koncentration af bufferopløsning, "Sagde Negishi." Som følge heraf, vi præciserede mekanismen for kompliceret sensorrespons, som ikke er blevet afklaret i tidligere rapporter. "
Mange forskellige funktioner i et eksperiment kan påvirke et molekyls Debye -længde, så disse resultater viser løfte om yderligere kontrol af sensorer og ændring af deres dynamiske område.
Næste, Negishi og hans kolleger håber at finde en måde at bruge deres fund i mere virkelige scenarier. "Til praktisk anvendelse, det er vigtigt at udvikle en sanseteknologi, der kan detekteres under høje koncentrationsforhold tæt på blod. "
 Varme artikler
Varme artikler
-
 Forskere bruger 3D-billeddannelse til at forbedre diagnosticering af muskelsygdommeSkeletmuskelvæv. Kredit:University of Michigan Medical School Bioteknologer ved Friedrich-Alexander-Universität Erlangen-Nürnberg (FAU) har udviklet et system til nøjagtigt at måle muskelsvaghed f
Forskere bruger 3D-billeddannelse til at forbedre diagnosticering af muskelsygdommeSkeletmuskelvæv. Kredit:University of Michigan Medical School Bioteknologer ved Friedrich-Alexander-Universität Erlangen-Nürnberg (FAU) har udviklet et system til nøjagtigt at måle muskelsvaghed f -
 Fysikere viser, hvordan livløse partikler kan blive livagtige ved at skifte adfærdBurton-laboratoriet studerer bittesmå, plastikpartikler som model for mere komplekse systemer. Partiklerne er suspenderet i et vakuumkammer fyldt med plasma -- ioniseret argongas. Kredit:Justin Burton
Fysikere viser, hvordan livløse partikler kan blive livagtige ved at skifte adfærdBurton-laboratoriet studerer bittesmå, plastikpartikler som model for mere komplekse systemer. Partiklerne er suspenderet i et vakuumkammer fyldt med plasma -- ioniseret argongas. Kredit:Justin Burton -
 Afspilning af numrene-en milliard-satsning på den europæiske røntgenlaserDen færdige europæiske røntgenlasertunnel, også kendt som XFEL Beschleunigertunnel, fotograferet i marts 2017. Kredit:European XFEL / Heiner Müller-Elsner Stor videnskab er et begreb, der oprindel
Afspilning af numrene-en milliard-satsning på den europæiske røntgenlaserDen færdige europæiske røntgenlasertunnel, også kendt som XFEL Beschleunigertunnel, fotograferet i marts 2017. Kredit:European XFEL / Heiner Müller-Elsner Stor videnskab er et begreb, der oprindel -
 Diamant - et uundværligt materiale inden for fusionsteknologiPolykrystallinske CVD -diamantskiver til vinduesenheder i fusionsreaktorer og gyrotroner. Kredit:Tanja Meißner, KIT Fusionskraftværker lover næsten ubegrænset klimavenlig energi, og forskere verde
Diamant - et uundværligt materiale inden for fusionsteknologiPolykrystallinske CVD -diamantskiver til vinduesenheder i fusionsreaktorer og gyrotroner. Kredit:Tanja Meißner, KIT Fusionskraftværker lover næsten ubegrænset klimavenlig energi, og forskere verde
- Harvard-astronomen hævder, at fremmede fartøjer besøgte os
- CEO Musk:Tesla når det ugentlige mål om at lave 5, 000 modeller 3s
- Kaffeforfalskning afdækket ved hjælp af ny metode
- Astronauter elsker at rocke det ud i rummet
- Ingeniører knækker et 58-årigt puslespil på vej mod kvantegennembrud
- Siden Paris-aftalen, klimakatastrofer stiger


