Ny 3-D billedteknologi gør fluorescensmikroskopi mere effektiv

Dr. Kevin Tsia (1. fra højre) og hans team udviklede en ny optisk billedteknologi for at gøre 3D-fluorescensmikroskopi mere effektiv og mindre skadelig. (Fra venstre:Dr. Yuxuan Ren, Dr. Queenie Lai og Dr. Kevin Tsia) Kredit:@The University of Hong Kong
Forskere har brugt fluorescensmikroskopi til at studere den indre funktion af biologiske celler og organismer i årtier. Imidlertid, mange af disse platforme er ofte for langsomme til at følge den biologiske handling i 3-D; og for ødelæggende for de levende biologiske prøver med kraftig lysbelysning.
For at løse disse udfordringer, et forskerhold ledet af Dr. Kevin Tsia, Lektor ved Institut for Elektro- og Elektronikteknik og programdirektør for Bachelor of Engineering in Biomedical Engineering ved University of Hong Kong (HKU), udviklet en ny optisk billeddannelsesteknologi - coded light-sheet array microscopy (CLAM) - som kan udføre 3-D billeddannelse ved høj hastighed, og er strømeffektiv og skånsom nok til at bevare levende prøver under scanning på et niveau, der ikke opnås med eksisterende teknologier.
Denne avancerede billedteknologi blev for nylig offentliggjort i Lys:Videnskab og applikationer . Der er indgivet en amerikansk patentansøgning for innovationen.
"CLAM tillader 3-D fluorescensbilleddannelse ved høj billedhastighed, der kan sammenlignes med state-of-the-art teknologi (~10'er volumener pr. sekund). Endnu vigtigere, det er meget mere strømbesparende, at være over 1, 000 gange skånsommere end standard 3-D mikroskoper, der er meget udbredt i videnskabelige laboratorier, hvilket i høj grad reducerer skaden på levende prøver under scanning, " forklarede Dr. Tsia.
Eksisterende 3-D biologiske mikroskopiplatforme er langsomme, fordi hele prøvens volumen skal scannes sekventielt og afbildes punkt for punkt, linje-for-linje eller plan-for-plan. I disse platforme, et enkelt 3D-snapshot kræver gentagen belysning af prøven. Prøverne er ofte belyst med tusinder til millioner gange mere intensitet end sollys. Dette vil sandsynligvis beskadige selve prøven, er derfor ikke gunstig for langsigtet biologisk billeddannelse til forskellige anvendelser som anatomisk videnskab, udviklingsbiologi og neurovidenskab.
I øvrigt, disse platforme udtømmer ofte hurtigt det begrænsede fluorescens-"budget" - en grundlæggende begrænsning, at fluorescerende lys kun kan genereres ved belysning i en begrænset periode, før det forsvinder permanent i en proces kaldet "foto-blegning, " som sætter en grænse for, hvor mange billedoptagelser der kan udføres på en prøve.

Coded Light-sheet Array Microscopy (CLAM) Kredit:@The University of Hong Kong
"Gentagen belysning på prøven fremskynder ikke kun fotoblegning, men genererer også for meget fluorescenslys, der ikke til sidst danner det endelige billede. Derfor, fluorescens-'budgettet' er stort set spildt i disse billeddannelsesplatforme, " tilføjede Dr. Tsia.
Hjertet i CLAM er at omdanne en enkelt laserstråle til en højdensitetsarray af 'lysark' ved brug af et par parallelle spejle, at sprede sig over et stort område af prøven som fluorescensexcitation.
"Billedet inden for hele 3D-volumenet optages samtidigt (dvs. paralleliseret), uden behov for at scanne prøven punkt-for-punkt eller linje-for-linje eller plan-for-plan som krævet af andre teknikker. En sådan 3-D parallelisering i CLAM fører til en meget skånsom og effektiv 3-D fluorescensbilleddannelse uden at ofre følsomhed og hastighed, " som påpeget af Dr. Yuxuan Ren, en postdoc-forsker om arbejdet. CLAM udkonkurrerer også de almindelige 3-D fluorescensbilleddannelsesmetoder ved at reducere effekten af fotoblegning.
For at bevare billedopløsningen og kvaliteten i CLAM, holdet henvendte sig til Code Division Multiplexing (CDM), en billedkodningsteknik, som er meget brugt i telekommunikation til at sende flere signaler samtidigt.
"Denne kodningsteknik giver os mulighed for at bruge en 2-D billedsensor til at fange og digitalt rekonstruere alle billedstabler i 3-D samtidigt. CDM har aldrig været brugt i 3-D-billeddannelse før. Vi adopterede teknologien, som blev en succes, " forklaret af Dr. Queenie Lai, en anden postdoc-forsker, der udviklede systemet.
Som en proof-of-concept demonstration, holdet anvendte CLAM til at optage 3-D-videoer af hurtig mikropartikelstrøm i en mikrofluidisk chip med en volumenhastighed på over 10 volumener pr. sekund, der kan sammenlignes med state-of-the-art teknologi.
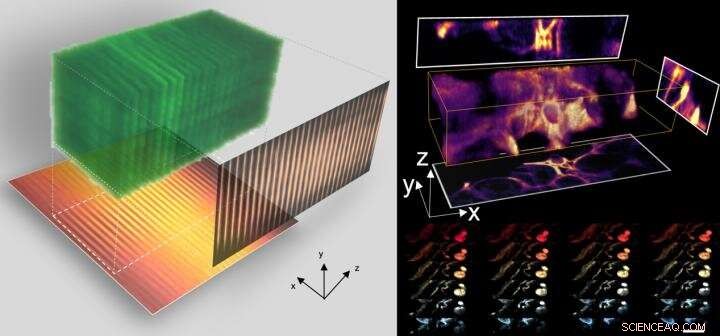
3D-billeddannelse ved høj hastighed med CLAM. Kredit:University of Hong Kong
"CLAM har ingen grundlæggende begrænsning i billeddannelseshastighed. Den eneste begrænsning er fra hastigheden af detektoren, der anvendes i systemet, dvs. kameraet til at tage snapshots. I takt med at højhastighedskamerateknologien konstant udvikler sig, CLAM kan altid udfordre sin grænse for at opnå en endnu højere hastighed i scanning, " fremhævet af Dr. Jianglai Wu, den postdoktorale forskning, der igangsatte arbejdet.
Teamet har taget et skridt videre for at kombinere CLAM med HKU LKS Det Medicinske Fakultets nyudviklede vævsrensningsteknologi til at udføre 3-D visualisering af mus glomeruli og tarmblodvaskulatur i høj billedhastighed.
"Vi forventer, at denne kombinerede teknik kan udvides til storstilet 3-D histopatologisk undersøgelse af arkivologiske prøver, som at kortlægge den cellulære organisation i hjernen til neurovidenskabelig forskning." sagde Dr. Tsia.
"Da CLAM-billeddannelse er betydeligt skånsommere end alle andre metoder, det favoriserer entydigt langsigtet og kontinuerlig 'overvågning' af biologiske prøver i deres levende form. Dette kan potentielt påvirke vores grundlæggende forståelse i mange aspekter af cellebiologi, f.eks. løbende at spore, hvordan et dyreembryo udvikler sig til dets voksne form; at overvåge i realtid, hvordan cellerne/organismerne bliver inficeret med bakterier eller vira; at se, hvordan kræftcellerne bliver dræbt af stoffer, og andre udfordrende opgaver, der ikke kan opnås af eksisterende teknologier i dag, " tilføjede Dr. Tsia.
CLAM kan tilpasses til mange nuværende mikroskopsystemer med minimal hardware- eller softwaremodifikation. Ved at udnytte dette, holdet planlægger yderligere at opgradere det nuværende CLAM-system til forskning i cellebiologi, dyre- og planteudviklingsbiologi.
 Varme artikler
Varme artikler
-
 Forskere viser tilfældige, transistorlaser, der kan manipuleres i nanoskalaEn kunstners skildring af en tilfældig laser. Kredit:Case Western Reserve University I det sidste halve århundrede, laserteknologi er vokset til en global industri med mange milliarder dollars og
Forskere viser tilfældige, transistorlaser, der kan manipuleres i nanoskalaEn kunstners skildring af en tilfældig laser. Kredit:Case Western Reserve University I det sidste halve århundrede, laserteknologi er vokset til en global industri med mange milliarder dollars og -
 NIST støjtermometri giver nøjagtige nye målinger af Boltzmann -konstantenDenne kvantespændingsstøjkilde (QVNS) giver et grundlæggende nøjagtigt spændingssignal, der kan sammenlignes med spændingsstøj fra elektroner i en modstand. Måling af spændingsstøj gjorde det muligt f
NIST støjtermometri giver nøjagtige nye målinger af Boltzmann -konstantenDenne kvantespændingsstøjkilde (QVNS) giver et grundlæggende nøjagtigt spændingssignal, der kan sammenlignes med spændingsstøj fra elektroner i en modstand. Måling af spændingsstøj gjorde det muligt f -
 Flydende lys viser social adfærdSpejlstrukturer med kanaler. Kredit:University of Twente Kan fotoner, lette partikler, virkelig kondensere? Og hvordan vil dette flydende lys opføre sig? Kondenseret lys er et eksempel på et Bose-
Flydende lys viser social adfærdSpejlstrukturer med kanaler. Kredit:University of Twente Kan fotoner, lette partikler, virkelig kondensere? Og hvordan vil dette flydende lys opføre sig? Kondenseret lys er et eksempel på et Bose- -
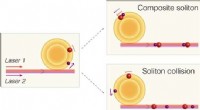 Kolliderende solitoner i optiske mikroresonatorer for at afsløre vigtig fundamental fysikSolitoner drevet af forskellige lasere, kan enten slutte sig til hinanden for at danne en udelt enhed eller gentagne gange støde ind i og krydse hinanden. Kredit:Weng Wenle/EPFL Solitoner er selvf
Kolliderende solitoner i optiske mikroresonatorer for at afsløre vigtig fundamental fysikSolitoner drevet af forskellige lasere, kan enten slutte sig til hinanden for at danne en udelt enhed eller gentagne gange støde ind i og krydse hinanden. Kredit:Weng Wenle/EPFL Solitoner er selvf
- Monster opdaget i canadisk Arktis
- Ny forskning i lyspartikler udfordrer forståelsen af kvanteteorien
- De miljømæssige omkostninger ved kontaktlinser
- Skovning af hele træer må ikke hindre planters biodiversitet
- Sjælden Groundcherry kunne snart være overalt,
- Hulehemmeligheder låst op for at vise tidligere tørke- og nedbørsmønstre


