Det tager en neutronstråle at finde en proton
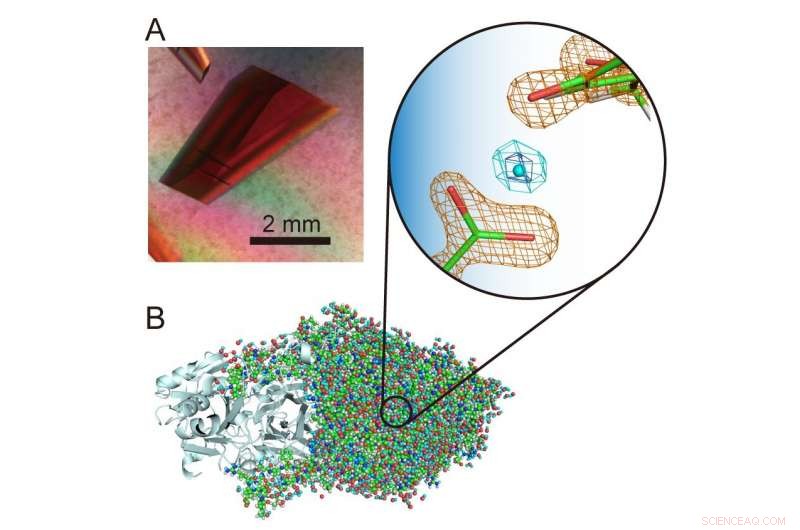
(A) Ekstra stor krystal af en kobberaminoxidase. (B) tredimensionel struktur af kobberaminoxidasen inklusive hydrogenatomer. En usædvanlig "svævet" proton præsenteres i midten af forstørret visning. Kredit:Osaka University
Forståelse af proteiners og enzymers adfærd er nøglen til at låse hemmelighederne ved biologiske processer op. Proteinernes atomstrukturer undersøges generelt ved hjælp af røntgenkrystallografi; imidlertid, de nøjagtige oplysninger om hydrogenatomer og protoner (hydrogenioner) er normalt uopnåelige. Nu et team, herunder Osaka University, Osaka Medical College, Nationale institutter for kvante- og radiologisk videnskab og teknologi, Ibaraki Universitet, og University of Tsukuba har brugt neutronkrystallografi til at afsløre strukturelle detaljer i høj opløsning af et meget stort oxidaseprotein. Deres resultater offentliggøres i PNAS .
Hydrogenatomer og protoner, der udgør omkring halvdelen af atomerne i proteiner og enzymer, spiller ofte afgørende roller i de opgaver, disse biomolekyler udfører; imidlertid, deres nøjagtige positioner er svære at identificere på grund af deres lille størrelse. Den mest almindelige metode til at udarbejde strukturen af et protein er at rette en stråle af højenergirøntgenstråler mod en proteinkrystal og analysere diffraktionsmønsteret, der skyldes røntgenstrålenes interaktioner med atomerne i atomerne i struktur. Desværre, Røntgenstråler interagerer ikke stærkt med hydrogenatomer eller protoner, som har lav eller ingen elektrontæthed, gør dem svære at "se".
En løsning er at anvende en neutronstråle på krystallen i stedet for røntgenstråler. Neutroner interagerer med atomernes kerner på deres vej, herunder hydrogenatomer og protoner, på trods af at de er små. Diffraktionsmønstrene som følge af disse interaktioner registreres, efter at neutronstrålen er passeret gennem krystallen, og afkodes til de præcise placeringer af kernerne, herunder brintkerner.
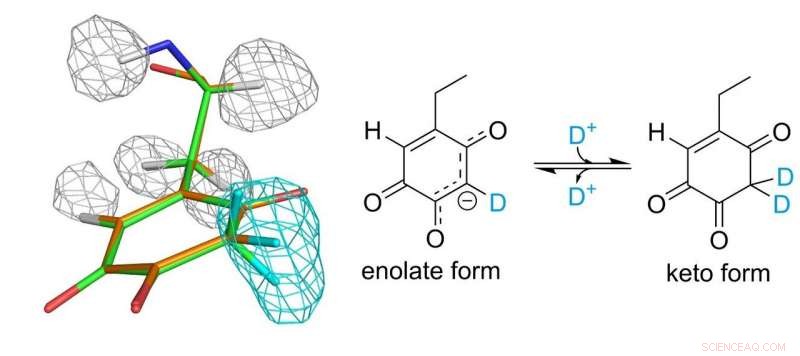
Struktur af topa quinon cofactor. Grå og lyseblå masker repræsenterer tætheder af hydrogen- og deuteriumatomer, henholdsvis. Kredit:Osaka University
"Hydrogenatomer og protoner er særlig interessante komponenter i enzymstrukturer, fordi de kan udvise kvanteadfærd, der for nylig har vist sig at være afgørende for enzymfunktionen. Det er derfor vigtigt at bestemme deres placeringer i proteinstrukturen nøjagtigt for at opklare, hvad der sker , "forklarer den tilsvarende forfatter Toshihide Okajima." Ved hjælp af neutronkrystallografi, vi var i stand til at bestemme strukturen af en bakteriel kobberaminoxidase med en molekylvægt på 70, 600 - hvilket er ekstremt stort for neutronkrystallografi og væsentligt overstiger tidligere registrerede molekylmasser - og stadig præcist lokaliserer hydrogenatomerne og protonerne i strukturen. En usædvanlig 'leviteret' proton blev observeret mellem en kofaktor, topa quinon, og en aminosyrerest strengt konserveret i denne klasse af enzymer. "
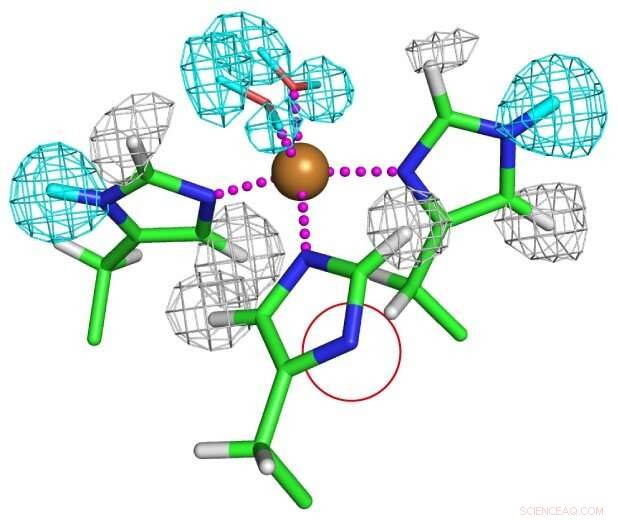
Protonationstilstand for kobberkoordinerede histidinrester. En af histidinresterne deprotoneres fuldstændigt som vist i en rød cirkel for at danne en usædvanlig imidazolat -anion. Kredit:Osaka University
Topakinon -kofaktoren kovalent bundet til enzymet spiller en væsentlig rolle i den katalytiske funktion. Forskerne var endelig i stand til at etablere et komplet billede af topa quinon 30 år efter dets opdagelse som en protein-afledt kofaktor. De fandt ud af, at kofaktoren faktisk eksisterer i ligevægt mellem to forskellige former.
"Enzymaktive steder - hvor reaktionerne finder sted - kan give os en masse information og inspiration, hvis vi er i stand til fuldt ud at forstå, hvad der sker, "Okajima forklarer." Vores demonstration af brug af neutronkrystallografi til at afdække protonkvanteffekter lover at være meget nyttig for mange forskere, der studerer enzymer og deres mekanismer. "
 Varme artikler
Varme artikler
-
 Blå hvirvelflammestruktur afsløret med supercomputereBlå hvirvler er et hvirvlende flammefænomen, der udvikler sig fra en kaotisk ildvirvel og brænder med næsten sodfri forbrænding. Supercomputersimuleringer har afsløret flammestrukturen og strømningsst
Blå hvirvelflammestruktur afsløret med supercomputereBlå hvirvler er et hvirvlende flammefænomen, der udvikler sig fra en kaotisk ildvirvel og brænder med næsten sodfri forbrænding. Supercomputersimuleringer har afsløret flammestrukturen og strømningsst -
 Multidimensionel, to-kanals hvirvelstrålegeneratorStrålegenerator. Kredit:Fan et al., doi:10.1117/1.AP.2.4.045001 Optiske hvirvler, kendetegnet ved en spiralformet fasefront og doughnut-formet intensitetsfordeling, bidrage til en bred vifte af ap
Multidimensionel, to-kanals hvirvelstrålegeneratorStrålegenerator. Kredit:Fan et al., doi:10.1117/1.AP.2.4.045001 Optiske hvirvler, kendetegnet ved en spiralformet fasefront og doughnut-formet intensitetsfordeling, bidrage til en bred vifte af ap -
 Hemmeligheden bag at gøre tingene bedre? Skyd det med en laserKredit:Northeastern University Hurtigere computere. Mere effektive solpaneler. Mere kraftfulde elbiler. Forskere ved Northeastern er med til at gøre disse teknologiske fremskridt til virkelighed.
Hemmeligheden bag at gøre tingene bedre? Skyd det med en laserKredit:Northeastern University Hurtigere computere. Mere effektive solpaneler. Mere kraftfulde elbiler. Forskere ved Northeastern er med til at gøre disse teknologiske fremskridt til virkelighed. -
 Hvordan vi skabte et mini gammastråleudbrud i laboratoriet for første gangIllustration af et gammastråleudbrud i rummet. Kredit:ESO/A. Roquette, CC BY-SA Gammastråler, intense lyseksplosioner, er de lyseste begivenheder, der nogensinde er observeret i universet - varer
Hvordan vi skabte et mini gammastråleudbrud i laboratoriet for første gangIllustration af et gammastråleudbrud i rummet. Kredit:ESO/A. Roquette, CC BY-SA Gammastråler, intense lyseksplosioner, er de lyseste begivenheder, der nogensinde er observeret i universet - varer
- Sådan beregnes procentvariation
- Lov om opkrævning af moms på internettet træder gradvist i kraft
- Eksempler på sekundære forurenende stoffer
- Sådan konverteres tommer til det metriske system
- Canetroller til svagtseende er designet til at udforske virtuelle verdener
- I deres nærmeste linje i 800 år, Jupiter og Saturn vil skabe et vidunder:En julestjerne


