Ny mikroskopimetode giver et hidtil uset kig på amyloidproteinstruktur
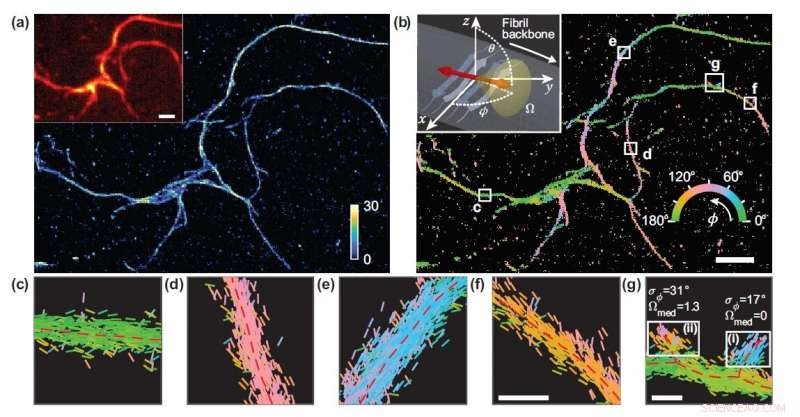
Forskere udviklede en mikroskopiteknik, der måler placeringen og orienteringen af enkelte molekyler og brugte den til at studere de strukturelle detaljer i amyloidproteinaggregater. (a) Enkeltmolekyle lokaliseringsmikroskopibillede af et netværk af amyloidaggregater. (b) Billede, der viser nilrøde bindingsorienteringer til amyloidoverflader, farvekodet i henhold til den gennemsnitlige orientering målt i hver beholder. (c-g) Individuelle orienteringsmålinger lokaliseret langs fibril-rygraden i de hvide felter i (b). Linjerne er orienteret og farvekodet i henhold til retningen af den estimerede vinkel. Vandrette hvide skalaer er længdemarkører, 1 mikron i (a), (b) og 100 nm i (f), (g). Kredit:Tianben Ding, Tingting Wu og Matthew D. Lew, Washington University i St. Louis
Neurodegenerative sygdomme som Alzheimers og Parkinsons er ofte ledsaget af amyloidproteiner i hjernen, der er blevet sammenklumpet eller fejlfoldet. En nyudviklet teknik, der måler orienteringen af enkelte molekyler, gør det muligt at bruge optisk mikroskopi, for første gang, at afsløre detaljer i nanoskala om strukturerne af disse problematiske proteiner.
Forskere fra Washington University i St. Louis beskriver deres nye tilgang i Optica , Det Optiske Selskabs tidsskrift.
"Neurodegenerative lidelser som Alzheimers og Parkinsons sygdomme er førende dødsårsager over hele verden, " sagde Tianben Ding, medførsteforfatter til det nye papir. "Vi håber, at vores enkelt-molekyle orientering billeddannelsestilgang kan give ny indsigt i amyloid struktur og muligvis bidrage til den fremtidige udvikling af effektive terapeutiske midler mod disse sygdomme."
Biologiske og kemiske processer i hjernen er drevet af komplicerede bevægelser og interaktioner mellem molekyler. Selvom de fleste amyloidproteiner kan være ugiftige, fejlfoldning af selv nogle få kunne i sidste ende dræbe mange neuroner.
"Vi har brug for billeddannelsesteknologier, der kan se disse molekylære bevægelser i levende systemer for at forstå de grundlæggende biologiske mekanismer af sygdom, "forklarede Matthew D. Lew, leder af forskergruppen. "Amyloid- og prion-type sygdomme som Alzheimers, Parkinsons og diabetes er vores første mål for denne teknologi, men vi ser det også blive brugt på mange andre områder."
Valg af det bedste mikroskop
Lews laboratorium har udviklet adskillige enkelt-molekyle super-opløsning mikroskopi metoder, der måler orienteringen og placeringen af fluorescerende molekyler knyttet til enkelte proteiner. Orienteringsoplysningerne opnås ved at måle ikke kun placeringen af fluorescens i prøven, men også karakteristika for det lys, såsom polarisering, som typisk ignoreres i de fleste andre mikroskopimetoder.
I deres Optica artikel, forskerne beskrev en præstationsmåling, de har designet til at karakterisere, hvor følsomt forskellige mikroskoper kan måle orienteringer af fluorescerende molekyler. Ved at bruge den nye præstationsindikator, forskerne fandt, at et mikroskop, der opdeler fluorescenslys i to polarisationskanaler (x og y), giver overlegne og praktiske orienteringsmålinger.
"Metricen, vi udviklede, beregner ydeevnen af et bestemt mikroskopdesign 1, 000 gange hurtigere end før, " sagde Tingting Wu, medførsteforfatter til værket. "Ved at måle orienteringerne af enkelte molekyler bundet til amyloidaggregater, det valgte mikroskop gjorde det muligt for os at kortlægge forskelle i amyloidstrukturens organisation, som ikke kan påvises af standardlokaliseringsmikroskoper."
Da der ikke er nogen kunstig forbindelse mellem de fluorescerende prober og amyloidoverflader, probernes bindingsorientering til amyloidoverfladerne formidler information om, hvordan selve amyloidproteinet er organiseret. Forskerne kvantificerede, hvordan orienteringen af fluorescerende molekyler varierede hver gang, der blev knyttet til et amyloidprotein. Forskelle i disse bindingsadfærd kan tilskrives strukturforskelle mellem amyloidaggregater. Fordi metoden giver enkelt-molekyle information, forskerne kunne observere forskelle i nanoskala mellem amyloidstrukturer uden at udligne detaljer om lokale træk.
Muligheder for længerevarende studier
"Vi planlægger at udvide metoden til at overvåge ændringer i nanoskala inden for og mellem amyloidstrukturer, når de organiserer sig over timer til dage, " sagde Ding. "Langtidsundersøgelser af amyloidaggregater kan afsløre nye sammenhænge mellem, hvordan amyloidproteiner er organiseret, og hvor hurtigt de vokser eller spontant opløses."
Forskerne bemærker, at det set-up, de brugte til orienterings-lokaliseringsmikroskopi, bestod af kommercielt tilgængelige dele, der er tilgængelige for alle, der udfører enkeltmolekyle super-opløsningsmikroskopi. Deres analysekode er tilgængelig på https://github.com/Lew-Lab/RoSE-O.
"Ved optisk mikroskopi og billeddannelse, videnskabsmænd og ingeniører har rykket grænserne for billeddannelse for at være hurtigere, sonde dybere og have højere opløsning, " sagde Lew. "Vores arbejde viser, at man kan kaste lys over grundlæggende processer i biologi ved at i stedet, med fokus på molekylær orientering, som kan afsløre detaljer om biologiens indre funktioner, som ikke kan visualiseres ved traditionel mikroskopi."
 Varme artikler
Varme artikler
-
 Metasurface genererer nye lystilstande til grundforskning og applikationerEn metasurface bruger cirkulært polariseret lys til at generere og kontrollere nye og komplekse lystilstande, sådanne hvirvlende hvirvler af lys. Det nye værktøj kan bruges til ikke kun at udforske ny
Metasurface genererer nye lystilstande til grundforskning og applikationerEn metasurface bruger cirkulært polariseret lys til at generere og kontrollere nye og komplekse lystilstande, sådanne hvirvlende hvirvler af lys. Det nye værktøj kan bruges til ikke kun at udforske ny -
 Eksperiment viser ikke-klassisk vækst af krystallerime sekvens af repræsentative billeder fra atomkraftmikroskopet, viser udfældningen og den efterfølgende transformation af de flydende forstadier på overfladen af en glutaminsyremonohydrat-enkeltkry
Eksperiment viser ikke-klassisk vækst af krystallerime sekvens af repræsentative billeder fra atomkraftmikroskopet, viser udfældningen og den efterfølgende transformation af de flydende forstadier på overfladen af en glutaminsyremonohydrat-enkeltkry -
 Udforskning af kvantetyngdekraft og sammenfiltring ved hjælp af pendulerI et atominterferometer, atomets bølgefunktion er opdelt i venstre og højre arm. Venstre og højre arme kombineres derefter igen, frembringer et interferensmønster. Kredit:S. Kelley/NIST Når det ko
Udforskning af kvantetyngdekraft og sammenfiltring ved hjælp af pendulerI et atominterferometer, atomets bølgefunktion er opdelt i venstre og højre arm. Venstre og højre arme kombineres derefter igen, frembringer et interferensmønster. Kredit:S. Kelley/NIST Når det ko -
 Undersøgelse peger på ikke-newtonsk kraft, der påvirker partiklernes flyvningKredit:Scott Schrage/University Communication Anførselstegnene havde traditionens kraft – og krafttraditionen – bag sig. Da Nebraskas Herman Batelaan og kolleger for nylig indsendte et forsknings
Undersøgelse peger på ikke-newtonsk kraft, der påvirker partiklernes flyvningKredit:Scott Schrage/University Communication Anførselstegnene havde traditionens kraft – og krafttraditionen – bag sig. Da Nebraskas Herman Batelaan og kolleger for nylig indsendte et forsknings
- Langsomme jordskælv i Cascadia er forudsigelige
- Ved at gå på vandrestier for at afdække den geologiske historie i det sydvestlige Japan
- Videnskabsprojekter med Neon & Atoms
- Forskning identificerer faktorer, der påvirker, hvordan religiøs identitet interagerer med arbejds…
- Ny mekanisme viser vejen til at bryde ribosom-antibiotikaresistens
- Asfalt øger luftforureningen, især på varmt, solskinsdage


