Forskere bruger bølgeledere til følsom proteaseovervågning

Kredit:CC0 Public Domain
For første gang, forskere har påvist proteaseaktivitet med overfladeforstærket Raman-spektroskopi (SERS) udført ved hjælp af en lille bølgeleder. Arbejdet baner vejen til realtid, etiketfri laboratorie-på-en-chip proteaseovervågning, som kunne tilbyde en high-throughput tilgang til screening for nye lægemidler, der hæmmer proteaser involveret i sygdom.
Proteaser nedbryder de peptidbindinger, der holder proteiner sammen. De er vigtige lægemiddelmål på grund af deres involvering i mange sygdomme, herunder kræft, Alzheimers sygdom, og gigt.
Nina Turk fra IMEC forskningscenter ved Gent Universitet i Belgien vil præsentere den nye forskning på den helt virtuelle OSA Frontiers in Optics and Laser Science APS/DLS (FiO + LS) konference, der afholdes 14.-17. september.
"Vi håber, at vores tværfaglige tilgang en dag kan muliggøre hurtig og effektiv opdagelse af nye lægemidler til en række forskellige protease-forbundet sygdomme, dermed forbedre livet for millioner af patienter rundt om i verden, " sagde Turk.
SERS på en chip
SERS bruger en metaloverflade med nanoskala ruhed til at forbedre svage signaler, der produceres, når lys interagerer med en prøve. På grund af dens høje følsomhed, spektroskopiteknikken kan detektere analytter i ekstremt små volumener. Selvom SERS er blevet brugt til følsom og selektiv påvisning af proteaser, dette er kun blevet påvist ved hjælp af en omfangsrig Raman-mikroskopiopsætning.
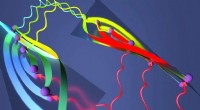
For nylig, nanoplasmoniske slot-bølgeledere er dukket op som en ny måde til effektivt at excitere og indsamle SERS-signaler. Disse bølgeledere består af to skinner, der danner et lille mellemrum, som lyset kan ledes igennem. Belægning af indersiden af mellemrummet med guld nanostrukturer kan bruges til at producere SERS-effekten. På grund af deres lille størrelse, bølgeledere kan indbygges på lab-on-a-chip enheder, muliggør samtidig måling af mange analytter til opdagelse af lægemidler med høj gennemstrømning.
For at se om disse nanoplasmoniske slot-bølgeledere ville være nyttige til SERS-detektion af proteaser, forskerne fremstillede en bølgeleder og designede et eksperiment til påvisning af trypsinproteasen. De skabte et specifikt peptidsubstrat for trypsin, der binder sig til guldnanostrukturen. Når trypsinpeptidet spalter til substratet, en del af underlaget diffunderer væk, skabe en detekterbar reduktion i intensitet for SERS-spektret.
Deres eksperiment afslørede et fald på 70% i SERS -intensitet efter en times trypsininkubation, viser, at nanoplasmoniske slot-bølgeledere kunne bruges til at detektere trypsin. Forskerne arbejder nu på at udvide deres platform, så den kan detektere aktiviteten af to eller flere proteaser samtidigt. Arbejdet var et samarbejde mellem Gent University-imec og det flamske institut for bioteknologi (VIB) under supervision af professorerne Roel Baets og Kris Gevaert.
 Varme artikler
Varme artikler
-
 Fysikere åbner døren til den første direkte måling af Berry -krumning i fast stofDenne kunstners gengivelse indeholder Berry -krumning repræsenteret af de snoede bånd øverst. Kredit:Brian Long Berry krumning er måske ikke det mest velkendte videnskabelige koncept, men for mang
Fysikere åbner døren til den første direkte måling af Berry -krumning i fast stofDenne kunstners gengivelse indeholder Berry -krumning repræsenteret af de snoede bånd øverst. Kredit:Brian Long Berry krumning er måske ikke det mest velkendte videnskabelige koncept, men for mang -
 Sådan beregnes enthalpy af AirLuftkonditioneringsingeniører skal overveje, hvordan deres enheder påvirker lufttemperaturen, som delvist bestemmes af varmeindholdet - målt i kilojoules (kJ) pr. Kg (kg) - af luften . Varmeindhold, e
Sådan beregnes enthalpy af AirLuftkonditioneringsingeniører skal overveje, hvordan deres enheder påvirker lufttemperaturen, som delvist bestemmes af varmeindholdet - målt i kilojoules (kJ) pr. Kg (kg) - af luften . Varmeindhold, e -
 Svage brintbindinger nøglen til stærke, hård infrastrukturRice University-forskere, der undersøgte grænsefladeinteraktionerne mellem polymer (blå) og cement (gul), opdagede, at den rigtige blanding af hydrogenbindinger er afgørende for at gøre stærke, hårde
Svage brintbindinger nøglen til stærke, hård infrastrukturRice University-forskere, der undersøgte grænsefladeinteraktionerne mellem polymer (blå) og cement (gul), opdagede, at den rigtige blanding af hydrogenbindinger er afgørende for at gøre stærke, hårde -
 Hvor meget vejer lys?Vejer lys noget? Godt, Ja og nej. agsandrew/iStock/Thinkstock Hvis der var et enkelt svar på, hvor meget lys vejer, vi ville alle vide det. Der ville sandsynligvis være en slags grundskolerim for at
Hvor meget vejer lys?Vejer lys noget? Godt, Ja og nej. agsandrew/iStock/Thinkstock Hvis der var et enkelt svar på, hvor meget lys vejer, vi ville alle vide det. Der ville sandsynligvis være en slags grundskolerim for at
- Undersøgelse peger på ikke-newtonsk kraft, der påvirker partiklernes flyvning
- Fleksibel isolator giver høj styrke og overlegen termisk ledning
- Har et videospil helbredt hiv?
- Tidligt valg af matematik blandt amerikanske immigrantbørn fører til STEM-karrierer
- Chandra finder stjerneduoer forvist fra galakser
- Et nyt materiale til at printe mekanisk robuste og formskiftende strukturer


