Fysisk virologi viser dynamikken i virusreproduktion
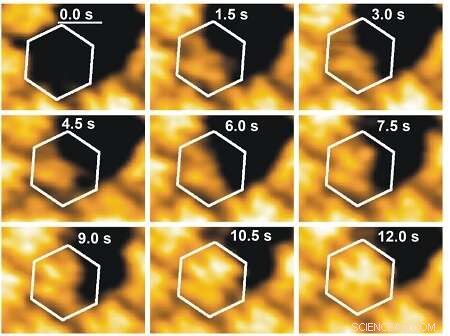
Dynamik af selvsamling af en viral proteinstruktur. Den hvide sekskant markerer den position, hvor en hexamer ved kanten af det voksende gitter gradvist dannes fra de enkelte virale proteinsubenheder. Kredit:Wouter Roos
Viruss reproduktionscyklus kræver selvsamling, modning af viruspartikler og efter infektion, frigivelse af genetisk materiale i en værtscelle. Nye fysikbaserede teknologier giver forskere mulighed for at studere dynamikken i denne cyklus og kan i sidste ende føre til nye behandlinger. I sin rolle som fysisk virolog, Wouter Roos, fysiker ved University of Groningen, sammen med to mangeårige kolleger, har skrevet en gennemgangsartikel om disse nye teknologier, som blev offentliggjort i Naturanmeldelser Fysik den 12. januar.
"Fysik har været brugt i lang tid til at studere vira, "siger Roos." Fysikkens love styrer vigtige begivenheder i deres reproduktive cyklus. "Nylige fremskridt inden for fysikbaserede teknikker har gjort det muligt at studere selvsamling og andre trin i reproduktionscyklussen af enkelte viruspartikler og på sub-sekund tidsopløsning. "Disse nye teknologier giver os mulighed for at se dynamikken i vira, "Tilføjer Roos.
Energi
I 2010, han offentliggjorde først en anmeldelseartikel om de fysiske aspekter ved virologi sammen med to af hans kolleger. "Dengang, næsten al forskning på vira var relativt statisk, for eksempel at lægge pres på en viruspartikel for at se, hvordan den reagerede. "På det tidspunkt, undersøgelser af dynamiske processer, såsom selvmontering, blev udført i løs vægt, uden mulighed for at zoome ind på individuelle partikler. "Dette har ændret sig i løbet af de sidste par år, og derfor vi syntes, det var tid til endnu en anmeldelse. "Dette papir, "Viral dynamics fysik, "blev medforfatter af Robijn Bruinsma fra University of California i Los Angeles (USA) og Gijs Wuite fra VU Amsterdam (Holland).
Vira kaprer celler og tvinger dem til at lave proteinets byggesten til nye viruspartikler og til at kopiere deres genetiske materiale (enten RNA eller DNA). Dette resulterer i en cellulær suppe fuld af virussdele, som samler sig selv for at producere partikler af indkapslet RNA eller DNA. "Der kræves ingen ekstern energi til denne proces. Og selv in vitro, de fleste vira vil hurtigt samle sig. "Denne proces blev traditionelt undersøgt i massemateriale, beregning af adfærd for et stort antal viruspartikler. "Så, vi anede ikke forskellen i sammensætningen af individuelle partikler. "
Sub-sekund scanninger
I løbet af de sidste par år, teknologier er blevet udviklet til at studere disse individuelle partikler i realtid. En af dem er hurtig Atomic Force Microscopy (AFM). Et atomkraftmikroskop scanner overflader med en spids i atomstørrelse og er derfor i stand til at kortlægge deres topologi. "For nylig, AFM's scanningshastighed steg dramatisk, og nu kan vi udføre sub-sekunders scanninger af overflader, der måler mindre end 1 mikrometer i firkant ved hjælp af højhastigheds-AFM, "siger Roos, der selv bruger en AFM. "Dette giver os mulighed for at se, hvordan virusunderenheder samles på en overflade. Det er en meget dynamisk proces, med byggeklodser, der fastgøres og frigøres. "
Enkeltmolekylfluorescens bruges også til at studere vira, for eksempel, vedhæftning af virale proteiner til DNA. "Ved hjælp af optisk pincet, vi holder to små perler i hver ende af et DNA -molekyle. Når virale proteiner binder sig til DNA'et, dette vil spole op og bringe de to perler tættere på hinanden. Dette visualiseres af fluorescerende markører fastgjort til perlerne. "Alternativt kan proteiner med fluorescerende markører kan observeres, mens de fæstner sig til viralt DNA eller til andre proteiner. En tredje teknologi er at bruge et optisk mikroskop til at måle interferens af lys, der er spredt af viruspartikler. Disse mønstre afslører partiklernes struktur under samling.
Tag dig sammen
Andre trin i viruscyklussen kan også studeres. "Efter at de har samlet sig selv, partikler skal strammes op for at modstå forhold uden for værtscellen, "siger Roos. Andre ændringer sker også, som forbereder partiklerne til at inficere andre celler. Dynamikken i denne modningsproces er vigtig for vores forståelse af, hvordan vira virker. "Og efter infektion af nye celler, viruspartiklen skal løsne sig for at frigive sit genetiske materiale. "
Ny teknologi afslører nu virussernes fysiske dynamik. Det giver forskere som Roos og hans kolleger mulighed for at studere, hvordan genetisk materiale er inkorporeret, og hvilke fysiske principper der styrer denne proces. De fleste antivirale lægemidler forstyrrer de første trin i infektion, såsom binding af viruspartikler til deres værtsceller. Ved hjælp af denne nye dynamiske information, vi kunne udvikle lægemidler, der blokerer selvsamling eller andre vigtige trin i virusets reproduktive cyklus.
Nanoteknologi
Indsigt i viruspartiklernes fysik er også vigtig for deres anvendelse i forskning, for eksempel som byggesten i nanoteknologi eller som bærere for antigener i vacciner. Flere af de førende COVID-19-vacciner bruger adenovirus til at levere genet til SARS-CoV-2 spike-proteinet til celler, som derefter udtrykker dette gen og følgelig genererer et immunrespons. "At forstå, hvordan adenoviruset kommer sammen og falder fra hinanden, kan hjælpe med at skabe mere stabile vacciner."
 Varme artikler
Varme artikler
-
 Fysikere udvikler teknik til at redde flere liv ved at vaccinere færre menneskerMetoden anvender komplekse data til at identificere mennesker, hvis aktivitetsmønstre gør dem mere tilbøjelige til at videregive en infektion. Kredit:University of Aberdeen Forskere ved University
Fysikere udvikler teknik til at redde flere liv ved at vaccinere færre menneskerMetoden anvender komplekse data til at identificere mennesker, hvis aktivitetsmønstre gør dem mere tilbøjelige til at videregive en infektion. Kredit:University of Aberdeen Forskere ved University -
 Fremstilling af fluorescerende chips ved hjælp af en inkjetprinterLommelaboratorium:Fraunhofer IOFs nye udskrivbare fluorescenssensorer håber at kunne tilbyde en hurtig og nem måde at opdage sygdomsmarkører i blodet. Kredit:Fraunhofer IOF Hver måltid er det samm
Fremstilling af fluorescerende chips ved hjælp af en inkjetprinterLommelaboratorium:Fraunhofer IOFs nye udskrivbare fluorescenssensorer håber at kunne tilbyde en hurtig og nem måde at opdage sygdomsmarkører i blodet. Kredit:Fraunhofer IOF Hver måltid er det samm -
 Ultrahurtige optiske feltioniserede gasser:En laboratorieplatform til undersøgelse af kinetiske pla…Indledende elektronhastighedsfordeling (EVD) af optisk felt induceret ionisering (OFI) heliumplasma. EVDer (A) til cirkulær polarisering (CP) og (B) til lineær polarisering (LP) laserpuls fra 3D OSIRI
Ultrahurtige optiske feltioniserede gasser:En laboratorieplatform til undersøgelse af kinetiske pla…Indledende elektronhastighedsfordeling (EVD) af optisk felt induceret ionisering (OFI) heliumplasma. EVDer (A) til cirkulær polarisering (CP) og (B) til lineær polarisering (LP) laserpuls fra 3D OSIRI -
 Emner til en speciale i computernetværkComputernetværk er en ingeniørdisciplin, der beskæftiger sig med forholdet mellem to eller flere computersystemer eller enheder, hvad enten det er via Internettet, et intranet eller et ekstranet. U
Emner til en speciale i computernetværkComputernetværk er en ingeniørdisciplin, der beskæftiger sig med forholdet mellem to eller flere computersystemer eller enheder, hvad enten det er via Internettet, et intranet eller et ekstranet. U
- Sådan bestemmes prøvestørrelse med middel- og standardafvigelse
- Asiatiske byer står over for en perfekt storm af miljømæssige farer
- Rystet, ikke rørt:Forskere spionerer molekylære manøvrer
- Forskere forudser en dramatisk stigning i oversvømmelser, tørke i Californien
- Hvordan man laver en science fair Poster
- Amazon flytter til at oprette sit eget laboratorium til medarbejdernes COVID-19-tests


