Ny kalibreringsprocedure til superopløselig hjernebilleddannelse
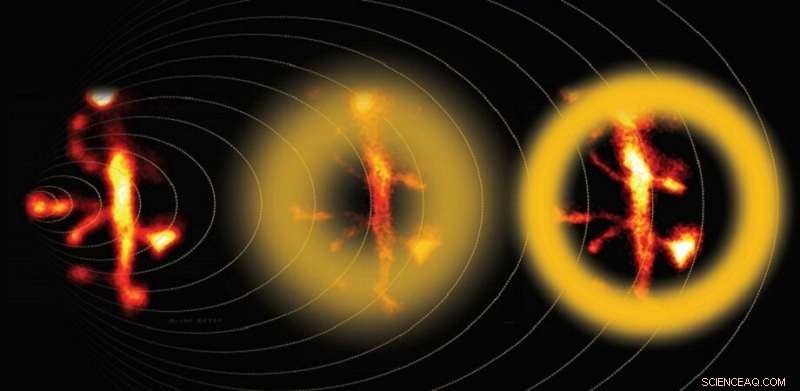
Multi-foton STED-mikroskopi forbedret med adaptiv optik fanger de fine detaljer i neuronale dendritter. Kredit:Bancelin et al.
Lys - og alle bølger - kan bøje rundt om hjørnerne af forhindringer, der findes langs dens vej. På grund af dette fænomen, kaldet diffraktion, det er umuligt at fokusere lyset på et sted, der er mindre end halvdelen af bølgelængden. Med andre ord, den højeste opløsning man teoretisk kan opnå ved hjælp af et optisk mikroskop er cirka 250 nm, en barriere kaldet diffraktionsgrænsen. Desværre, denne opløsning er ikke nok til at observere fine cellulære strukturer, såsom dem, der findes i neuroner.
I mere end et århundrede, mikroskopere blev strammet af denne klassiske barriere indtil opfindelsen af superopløselig fluorescensmikroskopi. En særlig kraftfuld tilgang blev udviklet i slutningen af 1990'erne og opfandt 'STED-mikroskopi' med stimuleret emission '. Denne teknik kræver, at målprøven indeholder fluoroforer, som er forbindelser, der absorberer lys ved en bølgelængde og derefter udsender det igen ved en længere. I den enkleste version af STED -mikroskopi, fluoroforer exciteres på et cirkulært sted ved bestråling med en diffraktionsbegrænset fokuseret laser. Derefter, en donutformet del omkring stedet bestråles med mindre energisk lys-udtømningsstrålen-som slukker fluorescensen ved processen med stimuleret emission. Dermed, nettoeffekten er, at kun fluoroforer i midten af donuten genudsender fotoner. Da området kan gøres vilkårligt lille, dette giver mulighed for superopløselig mikroskopi.
Selvom STED -mikroskopi var et sandt gennembrud for at observere morfologien for levende neuroner ved højere opløsning, der er stadig plads til forbedringer. I en nylig undersøgelse offentliggjort i Neurofotonik , et team af forskere ledet af Dr. U. Valentin Nägerl fra Université de Bordeaux udviklede en enkel, men effektiv kalibreringsmetode, der giver mulighed for mere præcis STED -billeddannelse ved højere vævsdybder. Deres tilgang er baseret på at analysere og korrigere for en af hovedkilderne til systematisk fejl i STED -mikroskopi for biologiske prøver:sfærisk aberration af udtømningsstrålen.
Ved billeddannelse af en vævsprøve på højere dybder end 40μm, udtømningsstrålen lider af forskellige former for defokusering og nedbrydning (aberration) og mister sin omhyggeligt udformede form, hvilket er afgørende for STED -metoden. Sfærisk aberration er den største lovovertræder og var den, forskerne målrettede sig mod. Deres strategi var først at forberede en hjernevævs fantomprøve, en gelbaseret proxy med et brydningsindeks svarende til selve hjernen. Denne fantomprøve indeholdt homogent dispergerede fluoroforer og guldnanopartikler, hvilket gjorde det muligt for teamet at tydeligt visualisere og kvantificere, hvordan formen på udtømningsstrålen blev forvrænget, da den trængte dybere. Derefter, de beregnede de nødvendige forudjusteringer, der skulle foretages i udtømningsstrålen i henhold til vævsdybde, så dens endelige form mere matcher den ideelle. Justeringerne blev foretaget ved hjælp af adaptiv optik, som er en teknologi, der oprindeligt blev udviklet af astronomer til at forbedre teleskopiske billeder, der lider af afvigelser forårsaget af jordens atmosfære.
Når formen på udtømningsstrålen var blevet kalibreret i henhold til fantomtestene, forskerne fortsatte med at billede levende neuralt væv. De sammenlignede resultaterne af almindelig STED -mikroskopi, korrigeret STED -mikroskopi, og to-fotonmikroskopi-en teknik, der er specifikt tilpasset billeddannelse af dybt væv. Resultaterne var ganske overbevisende:korrigerede STED -billeder fangede de fine detaljer i dybere neurale dendritter meget bedre end standard STED -billeder. "Ved hjælp af vores kalibreringsstrategi, vi kunne måle neuronale strukturer så små som 80 nm i en dybde på 90 um inde i biologisk væv og opnå en 60 procent signalforøgelse efter korrektion for sfærisk aberration, «siger Nägerl.
Ji Yi, professor i biomedicinsk teknik ved Johns Hopkins University bemærker, at "superopløselig mikroskopi primært er blevet anvendt til tynde prøver, såsom enkeltlagsceller, hvor lysspredning er ubetydelig. Teamet ledet af Valentin Nägerl implementerede adaptiv optik i en to-foton stimuleret emissionsudtømningsmikroskopi (2P-STED), og opnåede 80nm opløsning af billeddannende neuron dendritiske rygsøjler gennem 90 mikron hjernevæv. Dette er bemærkelsesværdigt, fordi superopløsning er svær at vedligeholde i tykkere væv-især i betragtning af den meget spredende kvalitet af hjernevæv. "Yi forklarer, at fremskridtet vil lette undersøgelse af neurale aktiviteter og interaktioner.
I betragtning af denne nye kalibreringsproces er robust, ligetil at implementere, og relativt billig, det kan let inkorporeres i standard laboratoriepraksis for at opnå bedre resultater med STED -mikroskoper, så længe den forberedte fantomprøve matcher de biologiske prøvens optiske egenskaber. I denne henseende Nägerl udtaler, "vores tilgang er ikke begrænset til hjerneprøver; den kan tilpasses andre væv med kendte og relativt homogene brydningsindekser, samt andre former for præparater, selv potentielt i det intakte, levende musens hjerne. "
 Varme artikler
Varme artikler
-
 Ny metode letter undersøgelse af kemikaliers virkninger på DNAKredit:CC0 Public Domain Fysikforskere fra University of Arkansas har udviklet en enkel, omkostningseffektiv metode til undersøgelse af kemikaliers virkninger på DNA, som har potentiale til at for
Ny metode letter undersøgelse af kemikaliers virkninger på DNAKredit:CC0 Public Domain Fysikforskere fra University of Arkansas har udviklet en enkel, omkostningseffektiv metode til undersøgelse af kemikaliers virkninger på DNA, som har potentiale til at for -
 Sådan konverteres glødevand til LED-wattLysemitterende dioder eller LED-pærer er meget mere energieffektive end old school glødepærer. Dette betyder, at det kræver mindre strøm eller færre watt at generere den samme mængde lys, som typis
Sådan konverteres glødevand til LED-wattLysemitterende dioder eller LED-pærer er meget mere energieffektive end old school glødepærer. Dette betyder, at det kræver mindre strøm eller færre watt at generere den samme mængde lys, som typis -
 Et skridt tættere på fusionsenergi:Billeddannelse muliggør bedre test af komponenter til enhederEksempel på tværsnitstomografi-dataskiver fra xy (øverst) og xz (nederste) plan for ITER_MB_ROI-prøven med en sammenligning af røntgen (venstre) kontra neutron (højre) tomografi billeddannelsesresulta
Et skridt tættere på fusionsenergi:Billeddannelse muliggør bedre test af komponenter til enhederEksempel på tværsnitstomografi-dataskiver fra xy (øverst) og xz (nederste) plan for ITER_MB_ROI-prøven med en sammenligning af røntgen (venstre) kontra neutron (højre) tomografi billeddannelsesresulta -
 Har fotoner masse?Når du først hører det, kan ideen om, at lys kan have masse, virke latterlig, men hvis det ikke har masse, hvorfor påvirkes lyset af tyngdekraften? Hvordan kunne der siges, at noget uden masse har
Har fotoner masse?Når du først hører det, kan ideen om, at lys kan have masse, virke latterlig, men hvis det ikke har masse, hvorfor påvirkes lyset af tyngdekraften? Hvordan kunne der siges, at noget uden masse har
- Større nordøstlige snestorme forventes at fortsætte med klimaændringer
- Den seneste vejrsatellit vil forbedre prognoserne for det vestlige USA, Alaska, Hawaii 12. februar 2…
- Jurassic fald i havets ilt varede en million år
- Genbrugsgale tyskere vender sig til at dele for at bekæmpe affald
- Data fra NASAs Solar Dynamics Observatory giver fingerpeg om solens koronale bestråling
- Undersøgelse identificerer en ny type daglig effekt for kosmisk stråleforstærket mørkt stof


