Verdens stærkeste syre:Et dybt dyk ned i ekstrem syre

Nogle syrer er sikre nok til, at selv en husejer kan bruge dem, som muriatinsyre. Den er designet til at blive brugt som husholdningsrengøringsmiddel, så længe du følger anvisningerne og alle sikkerhedsforanstaltninger. Nogle andre syrer er simpelthen for ætsende og ætsende til, at nogen kan håndtere det.
Så hvad sker der, når du blander to af dem? Du får noget helt stærkere. For eksempel, når lige store mængder af syrerne hydrogenfluorid (HF) og antimonpentafluorid (SbF5) kombineres, er resultaterne for bemærkelsesværdige til at ignorere.
Du får ikke bare nogen anden syre. Du ender med den stærkeste syre , eller supersyre, kendt af menneskeheden:fluorantimonsyre, aka HSbF6 .
Indhold- Hvad er Flouroantimonsyre?
- Fluoroantimonsyres kryptonit:Teflon
- Protonation:Fluoroantimonsyres superkraft
- Sammenligning med andre syrer
Hvad er Flouroantimonsyre?
Fluoroantimonsyre er en farveløs væske, der udsender en giftig damp. Synke eller indånde det kan være dødeligt, og hudkontakt? Tænk på alvorlige forbrændinger. Den står højt i kategorien supersyre, en gruppe af stærke syrer med sur styrke, der overgår svovlsyres.
På grund af dens styrke kan vi ikke bruge den almindelige pH- eller pKA-skala til at måle dens styrke. Her stjæler Hammett-syrefunktionen, betegnet som H, rampelyset.
Fluoroantimonsyre registrerer et H på -21, mens svovlsyres H måler -12. For at oversætte det, er fluorantimonsyre svimlende 20 × 10¹⁹ gange stærkere end ren svovlsyre.
Hvis dette var et opgør, ville det gerne have, at kaptajn Marvel kæmpede mod en nyfødt killing.
Hydrogenfluorid og hydrogenioner
Dette er rygraden i vores mester, fluorantimonsyre. Hydrogenioner gør et stof surt, og jo højere koncentrationen er, jo kraftigere er syren. Hydrogenfluorid er i sig selv ikke den stærkeste syre, men det er en nøglekomponent i nogle meget stærke.
Fluoroantimonsyres kryptonit:Teflon
På trods af sin overvældende styrke har fluorantimonsyre en akilleshæl:Den kan ikke erodere polytetrafluorethylen (PTFE), almindeligvis kendt som teflon.
Teflonbeholdere er således de udvalgte beholdere til at opbevare denne potente væske. En anden opbevaringsmetode er i en flussyreopløsning, hvor vores rekordholder ikke undergår eksplosiv nedbrydning.
Pas dog på - denne syre vil opløse glas, det meste plastik og enhver organisk forbindelse. Den reagerer endda eksplosivt med vand.
Det er absolut ikke et skolevidenskabeligt eksperiment. Det kræver respekt, bedst overladt til erfarne kemikere og eksperter i organisk kemi.
Protonation:Fluoroantimonsyres superkraft
Fluoroantimonsyres unikke talent er protonering - den donerer protoner til organiske forbindelser. Dette ændrer forbindelsens egenskaber som masse, opløselighed og hydrofilicitet.
Sådan en egenskab er uvurderlig for kemikere, der hjælper med kemiske reaktioner, ætsning af glas, raffinering af benzin og endda fremstilling af sprængstoffer. Selvom det har titlen som verdens stærkeste syre, hævder nogle, at flussyre er mere risikabelt på grund af dets tilstedeværelse i almindelige produkter, hvilket gør utilsigtet eksponering mere sandsynlig.
For dem, der er modige nok til at arbejde med supersyrer, er personligt beskyttelsesudstyr, herunder åndedrætsværn og beskyttelsesbriller, ikke til forhandling. Det er den moderne kemikers rustning mod et stof, der kan opløse kød og knogler på et øjeblik.
Sammenligning med andre syrer
Det kemiske område er stort, og mens fluorantimonsyre har sin ærede status, er der en række andre fascinerende syrer, der fortjener en omtale. Lad os udforske de unikke egenskaber ved disse syrer, dykke ned i deres styrker, svagheder og roller i forskellige processer.
Carboransyrer
Disse er blandt de stærkeste af de stærke syrer, næst efter fluorantimonsyre. Deres unikke molekylære struktur, understøttet af American Chemical Societys forskning, hjælper dem med at bevare deres styrke.
Det, der adskiller dem, er deres svage binding til hydrogenioner, hvilket gør dem mindre ætsende end fluorantimonsyre.
Magisk syre
Det lyder fantastisk, men magisk syre er meget ægte! Det dannes ved at blande fluorsvovlsyre (HSO₃F) og antimonpentafluorid (SbF₅). Denne syre dissocierer fuldstændigt i en vandig opløsning og frigiver en høj koncentration af hydrogenioner.
Salpetersyre, fosforsyre og perchlorsyre
Disse er eksempler på stærke syrer, der dissocierer fuldstændigt, når de opløses i vand. Selvom de måske ikke matcher den ekstreme surhedsgrad af fluorantimonsyre, er de essentielle i industrier, lige fra gødningsproduktion til raketdrivmiddel.
Benzosyre og oxalsyre
Disse svage syrer dissocierer ikke fuldstændigt i vand. Men de spiller en afgørende rolle i vores daglige liv, lige fra konservering af fødevarer til rengøringsmidler.
Hydroniumion
Alle syrer, når de er opløst i vand, producerer denne positivt ladede ion. Det er den virkelige synder bag en opløsnings sure egenskaber.
Denne artikel blev opdateret i forbindelse med AI-teknologi, og derefter faktatjekket og redigeret af en HowStuffWorks-redaktør.
Det er nu sjovt"Måder at ødelægge iPhones" er en underholdende genre på YouTube. Uanset om de er smadret med en hammer eller opløst med kemikalier som gallium, brom eller fluorantimonsyre, bruger borgerforskere en række metoder til at sætte holdbarheden af moderne teknologi på prøve.
Sidste artikelSådan bruges enhedscirklen i trigonometri
Næste artikelHvad er en nem måde at konvertere meter til fod?
 Varme artikler
Varme artikler
-
 Fejlfri kvanteberegning bliver virkeligKunstnerindtryk af gate-operationer på logiske kvantebits, der er beskyttet mod fejl ved hjælp af kvantefejlkorrektion. Kredit:Johannes Knünz I moderne computere er fejl under behandling og opbevar
Fejlfri kvanteberegning bliver virkeligKunstnerindtryk af gate-operationer på logiske kvantebits, der er beskyttet mod fejl ved hjælp af kvantefejlkorrektion. Kredit:Johannes Knünz I moderne computere er fejl under behandling og opbevar -
 Elektronisk aktivitet, der tidligere var usynlig for elektronmikroskoper, afsløretEn ny billedbehandlingsteknik producerer et topografisk kort, der viser, hvordan elektroner flyder mellem to elektroder, noteret med blåt. Kredit:Regan Research Group/UCLA De chips, der driver hve
Elektronisk aktivitet, der tidligere var usynlig for elektronmikroskoper, afsløretEn ny billedbehandlingsteknik producerer et topografisk kort, der viser, hvordan elektroner flyder mellem to elektroder, noteret med blåt. Kredit:Regan Research Group/UCLA De chips, der driver hve -
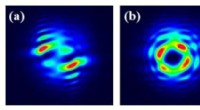 Ubehageligt baggrundslys hjælper med at fremme kalibrering af rumlig lysmodulatorDiffraktionsmønstre af vortexfase på SLM med (a) ukalibreret tilgang, b) interferometri og c) den foreslåede metode. Kredit:SIOM Rumlig lysmodulator (SLM) bruges i vid udstrækning i strålemanipula
Ubehageligt baggrundslys hjælper med at fremme kalibrering af rumlig lysmodulatorDiffraktionsmønstre af vortexfase på SLM med (a) ukalibreret tilgang, b) interferometri og c) den foreslåede metode. Kredit:SIOM Rumlig lysmodulator (SLM) bruges i vid udstrækning i strålemanipula -
 Revolutionært kvantegennembrud baner vejen for sikrere onlinekommunikationNetværket i drift. Figuren viser modtagehardwaren for alle 8 brugere. Kredit:Siddarth K. Joshi Verden er et skridt tættere på at have et fuldstændig sikkert internet og et svar på den voksende tru
Revolutionært kvantegennembrud baner vejen for sikrere onlinekommunikationNetværket i drift. Figuren viser modtagehardwaren for alle 8 brugere. Kredit:Siddarth K. Joshi Verden er et skridt tættere på at have et fuldstændig sikkert internet og et svar på den voksende tru
- Ny supergigantisk hurtig røntgentransient opdaget
- Lagdelt grafen sandwich til næste generations elektronik
- Udnyttelse af naturens skjold:Forbedrer solbeskyttelse med lignin-nanopartikler i kosmetik
- Sådan beregnes en persons mængde
- Sikke en tur! Forskere tager molekyler for en tur (med video)
- Mexico identificerer nedsænket vrag af Maya-slaveskib


