Hvordan virker loven om bevarelse af masse, og hvordan relaterer den sig til kemiske ligninger?
Kemiske ligninger , også kendt som afbalancerede kemiske ligninger, er symbolske repræsentationer af kemiske reaktioner. De bruger kemiske formler til at vise reaktanter, produkter og deres relative mængder involveret i en kemisk reaktion.
Loven om bevarelse af masse er tæt forbundet med begrebet afbalancering af kemiske ligninger , hvor koefficienter bruges til at justere de støkiometriske forhold mellem reaktanter og produkter for at sikre, at den samlede masse på begge sider af ligningen er ens. Koefficienter repræsenterer det relative antal molekyler, mol eller formelenheder for hvert stof, der er involveret i reaktionen.
For at afbalancere en kemisk ligning placeres koefficienter foran de kemiske formler, ikke som abonnenter inden for formlerne. Koefficienter tilføjes uden at ændre de kemiske formler eller underskrifter. Balancering sikrer, at den samlede masse af reaktanterne er lig med den samlede masse af produkterne.
Overvej for eksempel følgende ubalancerede kemiske ligning for forbrænding af metan:
CH4 + O2 -> CO2 + H2O
For at afbalancere denne ligning skal vi tilføje koefficienter for at sikre, at antallet af atomer i hvert grundstof er ens på begge sider af ligningen. Vi starter med at balancere carbonatomerne:da der er et carbonatom på venstre side og et carbonatom på højre side, er der ingen koefficienter nødvendige for CH₄ og CO₂.
Dernæst balancerer vi brintatomerne:der er fire brintatomer på venstre side og to brintatomer på højre side. For at afbalancere dette skal vi placere en koefficient på 2 foran H₂O-molekylet:
CH4 + O2 → CO2 + 2 H2O
Nu balancerer vi oxygenatomerne:der er to oxygenatomer på venstre side og fire oxygenatomer på højre side. For at afbalancere dette skal vi placere en koefficient på 2 foran O₂-molekylet:
CH4 + 2 O2 → CO2 + 2 H2O
Ved at tilføje disse koefficienter har vi sikret, at den samlede masse af reaktanterne (CH4 og 2 O₂) er lig med den samlede masse af produkterne (CO₂ og 2 H₂O), hvilket opfylder loven om bevarelse af masse.
Sammenfattende er loven om bevarelse af masse et grundlæggende princip, der kræver, at den samlede masse af reaktanter i en kemisk reaktion er lig med den samlede masse af produkter. Dette koncept afspejles direkte i afbalancering af kemiske ligninger, hvor koefficienter justeres for at sikre, at antallet af atomer i hvert grundstof er ens på begge sider, og derved opretholder reaktionens samlede massebalance.
 Varme artikler
Varme artikler
-
 Kompleks væskedynamik kan forklare hydroplaningEksperimentel opsætning til visualisering af vandgennemstrømning i dækriller, sammen med nogle prøveresultater. Kredit:Serge Simoens Når et køretøj kører over en våd eller oversvømmet vej, vand sa
Kompleks væskedynamik kan forklare hydroplaningEksperimentel opsætning til visualisering af vandgennemstrømning i dækriller, sammen med nogle prøveresultater. Kredit:Serge Simoens Når et køretøj kører over en våd eller oversvømmet vej, vand sa -
 Hvordan fysik kan hjælpe os med at forstå multiversvanvidKunne der være universer parallelt med vores? Kredit:Shutterstock Hvis du er fan af science fiction-film, vil du sandsynligvis være bekendt med ideen om alternative universer - hypotetiske eksisten
Hvordan fysik kan hjælpe os med at forstå multiversvanvidKunne der være universer parallelt med vores? Kredit:Shutterstock Hvis du er fan af science fiction-film, vil du sandsynligvis være bekendt med ideen om alternative universer - hypotetiske eksisten -
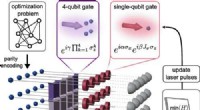 Forskere udvikler quantum gate, der muliggør undersøgelse af optimeringsproblemerRydberg paritet QAOA protokol. Vilkårligt forbundne optimeringsproblemer kan paritetskodes i en regulær geometri af neutrale atomer fanget i f.eks. en optisk pincet. Efter initialisering af Rydberg-kv
Forskere udvikler quantum gate, der muliggør undersøgelse af optimeringsproblemerRydberg paritet QAOA protokol. Vilkårligt forbundne optimeringsproblemer kan paritetskodes i en regulær geometri af neutrale atomer fanget i f.eks. en optisk pincet. Efter initialisering af Rydberg-kv -
 Små kameralinser kan hjælpe med at koble kvantecomputere til netværketKai Wang holder en prøve, der har flere metasurface kameralinser. Kredit:Lannon Harley, ANU Et internationalt team af forskere under ledelse af The Australian National University (ANU) har opfunde
Små kameralinser kan hjælpe med at koble kvantecomputere til netværketKai Wang holder en prøve, der har flere metasurface kameralinser. Kredit:Lannon Harley, ANU Et internationalt team af forskere under ledelse af The Australian National University (ANU) har opfunde
- En lillebitte, magnetisk aktiveret gearkasse, der giver mikrorobotter mere kraft
- At kalde det en krig mod videnskaben har konsekvenser
- Hvordan hjernedød virker
- Østrig formår ikke at vinde naboer til udfasning af atomkraft
- Undersøgelse viser, hvordan folk opfatter køn gennem tale
- Klimaforandringernes positive sider? Forskning viser landbrug, økonomiske muligheder


