Loven om massehandling tyder på?
Det betyder, at hastigheden af en reaktion vil stige, når koncentrationerne af reaktanterne stiger, og den vil falde, når koncentrationerne af reaktanterne falder. De støkiometriske koefficienter for reaktanterne fortæller os, hvor mange molekyler af hver reaktant der er involveret i reaktionen, og de bruges til at bestemme eksponenterne, som koncentrationerne af reaktanterne hæves til.
Overvej for eksempel følgende reaktion:
aA + bB → cC + dD
Loven om massehandling siger, at hastigheden af denne reaktion er givet ved følgende ligning:
rate =k[A]^a[B]^b
hvor k er hastighedskonstanten for reaktionen.
Denne ligning fortæller os, at reaktionshastigheden er direkte proportional med produktet af koncentrationerne af A og B, hver hævet til styrken af dens støkiometriske koefficient. I dette tilfælde er de støkiometriske koefficienter for A og B henholdsvis a og b.
Loven om massevirkning er et grundlæggende princip for kemisk kinetik, og den bruges til at forstå og forudsige hastigheden af kemiske reaktioner.
Sidste artikelhvad er volumen optaget af 15 g helium?
Næste artikelHvornår stopper ilt, hvor langt oppe?
 Varme artikler
Varme artikler
-
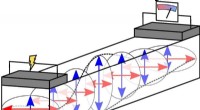 Fysikere bruger antiferromagnetisk rust til at transportere information over lange afstande ved stue…En elektrisk strøm ophidser superpositionen af to magnoner med lineær polarisering (angivet med de røde og blå pile). Efterfølgende, energi transporteres gennem den antiferromagnetiske isolator. Det
Fysikere bruger antiferromagnetisk rust til at transportere information over lange afstande ved stue…En elektrisk strøm ophidser superpositionen af to magnoner med lineær polarisering (angivet med de røde og blå pile). Efterfølgende, energi transporteres gennem den antiferromagnetiske isolator. Det -
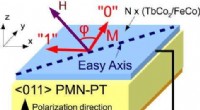 Magnetoelektrisk hukommelsescelle øger energieffektiviteten til datalagringMELRAM-celle og det elektriske skema for den magnetiske tilstandsidentifikation. Kredit:(c) Anvendt fysik bogstaver (2017). DOI:10.1063/1.4983717 Nutidens computere giver lagring af enorme mængd
Magnetoelektrisk hukommelsescelle øger energieffektiviteten til datalagringMELRAM-celle og det elektriske skema for den magnetiske tilstandsidentifikation. Kredit:(c) Anvendt fysik bogstaver (2017). DOI:10.1063/1.4983717 Nutidens computere giver lagring af enorme mængd -
 Første højpræcisionsmåling af massen af W boson ved LHCVisning af en kandidatbegivenhed for en W boson, der henfalder til en muon og en neutrino fra proton-protonkollisioner registreret af ATLAS med LHC-stabile stråler ved en kollisionsenergi på 7 TeV. (B
Første højpræcisionsmåling af massen af W boson ved LHCVisning af en kandidatbegivenhed for en W boson, der henfalder til en muon og en neutrino fra proton-protonkollisioner registreret af ATLAS med LHC-stabile stråler ved en kollisionsenergi på 7 TeV. (B -
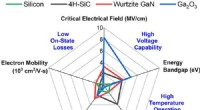 Vurdering af løftet om galliumoxid som en ultrawid bandgap -halvlederPentagon -diagrammet, der viser de kritiske materialegenskaber, der er vigtige for at drive halvlederindretninger. Kredit: Journal of Applied Physics (2018). DOI:10.1063/1.5062841 I mikroelektron
Vurdering af løftet om galliumoxid som en ultrawid bandgap -halvlederPentagon -diagrammet, der viser de kritiske materialegenskaber, der er vigtige for at drive halvlederindretninger. Kredit: Journal of Applied Physics (2018). DOI:10.1063/1.5062841 I mikroelektron
- Er de globale CO2-emissioner på vej tilbage til niveauer før COVID-19?
- Rover-billeder bekræfter, at Jezero-krateret er en gammel Mars-sø
- Donald Trumps Space Force-planer analyseret af en sci-fi-ekspert
- Sådan kombineres kemiske ligninger
- Forbindelse af kystnære processer med globale systemer
- Billede:Skumforgrovningseksperimentet på ISS


