Hvis volumen af en beholderluft reduceres?
* Øget tryk: Ifølge Boyles lov, når volumenet af en gas falder, mens temperaturen forbliver konstant, stiger trykket af gassen. Dette skyldes, at gasmolekylerne komprimeres til et mindre rum, hvilket fører til hyppigere kollisioner og øget tryk.
* Øget tæthed: Når volumenet falder, bliver gasmolekylerne tættere pakket, hvilket resulterer i en højere tæthed af luften inde i beholderen.
* Ingen ændring i temperatur: Hvis kompressionsprocessen er adiabatisk (dvs. ingen varme udveksles med omgivelserne), forbliver luftens temperatur konstant. Dette skyldes, at kompressionsarbejdet på gassen omdannes fuldstændigt til intern energi, hvilket øger den gennemsnitlige kinetiske energi af gasmolekylerne, men ikke ændrer deres samlede temperatur.
* Øget potentiel energi: Kompressionsprocessen lagrer potentiel energi i den komprimerede luft. Denne energi kan frigives, når trykket slippes, hvilket får luften til at udvide sig og udføre arbejde.
* Ændringer i andre egenskaber: Afhængigt af de specifikke forhold kan reduktion af volumen af en beholder med luft også påvirke andre egenskaber såsom fugtighed, opløselighed af gasser og kemisk reaktivitet.
Samlet set fører reduktion af volumen af en beholder med luft til øget tryk, tæthed og potentiel energi, mens temperaturen forbliver konstant, hvis processen er adiabatisk.
 Varme artikler
Varme artikler
-
 Reimagine information behandlingKredit:West Virginia University Fordi teknologi er en del af vores hverdag, det kan være svært at forestille sig, hvordan teknologiens fremtid vil se ud, endsige hvad det har potentiale til at opn
Reimagine information behandlingKredit:West Virginia University Fordi teknologi er en del af vores hverdag, det kan være svært at forestille sig, hvordan teknologiens fremtid vil se ud, endsige hvad det har potentiale til at opn -
 Forskere når en milepæl inden for kvantestandardiseringKredit:CC0 Public Domain Forskere ved University of Waterloo har udviklet en metode, der kan bane vejen for at etablere universelle standarder for måling af kvantecomputeres ydeevne. Den nye meto
Forskere når en milepæl inden for kvantestandardiseringKredit:CC0 Public Domain Forskere ved University of Waterloo har udviklet en metode, der kan bane vejen for at etablere universelle standarder for måling af kvantecomputeres ydeevne. Den nye meto -
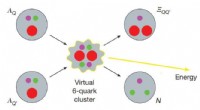 Teoretisk kvarkfusion viste sig at være mere kraftfuld end brintfusionSkematisk afbildning af eksoterme fusionsreaktioner på kvarkniveau ΛQΛQ′ → ΞQQ′N, hvor Q, Q′ ∈ {b, c}. Kredit:(c) Natur (2017). DOI:10.1038/nature24289 (Phys.org) – Et par forskere fra Tel Aviv
Teoretisk kvarkfusion viste sig at være mere kraftfuld end brintfusionSkematisk afbildning af eksoterme fusionsreaktioner på kvarkniveau ΛQΛQ′ → ΞQQ′N, hvor Q, Q′ ∈ {b, c}. Kredit:(c) Natur (2017). DOI:10.1038/nature24289 (Phys.org) – Et par forskere fra Tel Aviv -
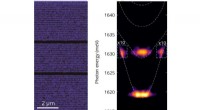 Ikke-lineære effekter i koblede optiske mikrokaviteterTil venstre:et rumligt tværsnit af den undersøgte struktur. To optiske mikrokaviteter (brede sorte striber) er synlige, omgivet af et flerlags Bragg-spejle. Billedet viser den rumlige fordeling af mag
Ikke-lineære effekter i koblede optiske mikrokaviteterTil venstre:et rumligt tværsnit af den undersøgte struktur. To optiske mikrokaviteter (brede sorte striber) er synlige, omgivet af et flerlags Bragg-spejle. Billedet viser den rumlige fordeling af mag
- Automatisk bortskaffelse af feminin hygiejne til udviklingssamfund
- Naturbrande påvirker vandkvaliteten
- Hvordan skovbrande også har indflydelse på søer
- Dyr rigeligt, plads til en præmie i Afrikas ældste zoo
- Hvordan får man planter til at vokse på Mars?
- Grupper sagsøger for at forhindre Trump i at forny offshore-boringer


