Hvilke intermolekylære kræfter er til stede i SiF4?
Siliciumtetrafluorid (SiF4) er en molekylær forbindelse sammensat af et centralt siliciumatom bundet til fire fluoratomer. Siliciumatomet er omgivet af et tetraedrisk arrangement af fluoratomer, og molekylet er upolært. Selvom molekylet i sig selv er upolært, oplever det intermolekylære kræfter. Disse kræfter er kendt som van der Waals-kræfter.
Van der Waals-kræfter er svage intermolekylære interaktioner, der forekommer mellem alle molekyler. De omfatter tre forskellige typer interaktioner:permanente dipol-permanente dipol-interaktioner, inducerede dipol-inducerede dipol-interaktioner og London-dispersionskræfter:
- Permanente dipol-permanente dipol-interaktioner opstår mellem molekyler, der har permanente dipoler. I tilfælde af SiF4 er der ikke noget permanent dipolmoment, fordi molekylet er symmetrisk, og ladningerne er jævnt fordelt. Derfor er permanente dipol-permanente dipol-interaktioner ikke til stede.
- Inducerede dipol-inducerede dipol-interaktioner opstår mellem molekyler, der har midlertidige dipoler. Disse midlertidige dipoler skabes, når elektronskyerne i to molekyler svinger og bliver let polariserede. Udsvingene i elektronskyerne i et molekyle kan inducere en dipol i et nabomolekyle. Denne interaktion er relativt svag og er kun signifikant, når molekylerne er meget tæt på hinanden. I SiF4 er inducerede dipol-inducerede dipol-interaktioner den svageste af de tre typer van der Waals-kræfter på grund af den næsten sfæriske elektronsky af silicium.
- Londonske spredningskræfter er de stærkeste af van der Waals-kræfterne og forekommer mellem alle molekyler, også dem der er upolære. Londons spredningskræfter er forårsaget af de midlertidige udsving i molekylernes elektronskyer. Disse fluktuationer kan skabe øjeblikkelige dipoler, som derefter kan inducere dipoler i nabomolekyler. London-spredningskræfter er til stede i SiF4 og er den primære kraft, der er ansvarlig for tiltrækningen mellem SiF4-molekyler. Da London-spredningskræfterne generelt er stærkere for større molekyler, er de mere signifikante for SiF4 end for mindre molekyler som CO2 eller H2O.
Sammenfattende er de intermolekylære kræfter, der er til stede i SiF4, van der Waals-kræfter , som omfatter inducerede dipol-inducerede dipol-interaktioner og Londonske spredningsstyrker . Permanente dipol-permanente dipolinteraktioner er ikke til stede i SiF4 på grund af fraværet af et permanent dipolmoment.
Sidste artikelHvilket grundstof har 9 elektroner protoner og 10 neutroner?
Næste artikelHvad er et luftpartikeldiagram?
 Varme artikler
Varme artikler
-
 Ny teori om oprindelsen af mørkt stofBeregninger til den nye model for mørkt stof udviklet på Mainz University. Kredit:Michael Baker, JGU Kun en lille del af universet består af synligt stof. Langt den største del er usynlig og bestå
Ny teori om oprindelsen af mørkt stofBeregninger til den nye model for mørkt stof udviklet på Mainz University. Kredit:Michael Baker, JGU Kun en lille del af universet består af synligt stof. Langt den største del er usynlig og bestå -
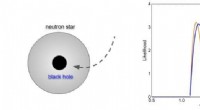 Etablering af oprindelsen til solmasser sorte huller og forbindelsen til mørkt stof[Venstre] Et lille ur -sort hul, der bliver fanget af en neutronstjerne, efterfølgende sluger det og efterlader et transmuteret solmassesort hul tilbage. [Til højre] Forventet massefordeling af transm
Etablering af oprindelsen til solmasser sorte huller og forbindelsen til mørkt stof[Venstre] Et lille ur -sort hul, der bliver fanget af en neutronstjerne, efterfølgende sluger det og efterlader et transmuteret solmassesort hul tilbage. [Til højre] Forventet massefordeling af transm -
 Columbia leder indsatsen for at udvikle en kvantesimulatorColumbia er en af 11 institutioner landsdækkende, der modtager en Phase One National Science Foundation Convergence Accelerator-pris for kvanteteknologi. Programmet er designet til at fremme tværfag
Columbia leder indsatsen for at udvikle en kvantesimulatorColumbia er en af 11 institutioner landsdækkende, der modtager en Phase One National Science Foundation Convergence Accelerator-pris for kvanteteknologi. Programmet er designet til at fremme tværfag -
 Snefnug er ikke så unikt, som du trorKredit:Northeastern University Den sarte sne suser, som du ser falde fra dit vindue, skovl af dit fortov, og bande, når de bliver til sjappytter, have et ret langt eventyr, før de når jorden. Et s
Snefnug er ikke så unikt, som du trorKredit:Northeastern University Den sarte sne suser, som du ser falde fra dit vindue, skovl af dit fortov, og bande, når de bliver til sjappytter, have et ret langt eventyr, før de når jorden. Et s
- Sammensætning af multikomponentlegeringer ved screening med høj gennemstrømning
- Klimaændringer:Slet 90 % af verdens kul og 60 % af olie og gas for at begrænse opvarmningen til 1,…
- Hvilken funktion har ribosomer i celler?
- Undersøgelse af en nuklear ur-overgang
- Små bobler på elektroderne er nøglen til at fremskynde kemiske processer
- Enkle eksperimenter for forholdet mellem diffusion og temperatur


