Hvad er massen af 43,7 L helium ved STP?
Vi kan bruge den ideelle gaslov til at beregne massen af helium:
$$PV =nRT$$
hvor:
- P er trykket i atm
- V er volumen i liter
- n er mængden af stof i mol
- R er den ideelle gaskonstant (0,08206 L * atm / mol * K)
- T er temperaturen i Kelvin
Hvis vi omarrangerer ligningen for at løse for n, får vi:
$$n =PV/RT$$
Erstatning af de givne værdier:
$$n =(1 atm * 43,7 L) / (0,08206 L * atm / mol * K * 273,15 K)$$
$$n =1,923 mol$$
Endelig kan vi beregne massen af helium ved at gange mængden af stof med den molære masse:
$$masse =n * molær masse$$
$$masse =1,923 mol * 4,0026 g/mol$$
$$masse =7,71 g$$
Derfor er massen af 43,7 L helium ved STP 7,71 g.
Sidste artikelHvad er massetallet for et atom med 11 protoner elektroner 12 neutroner?
Næste artikelHvorfor flyver elektroner fra et atom?
 Varme artikler
Varme artikler
-
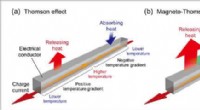 Verdens første direkte observation af magneto-Thomson-effektenFigur 1. Skematisk illustration af Thomson-effekten og magneto-Thomson-effekten. Kredit:National Institute for Materials Science Påføring af en temperaturgradient og en ladestrøm til en elektrisk
Verdens første direkte observation af magneto-Thomson-effektenFigur 1. Skematisk illustration af Thomson-effekten og magneto-Thomson-effekten. Kredit:National Institute for Materials Science Påføring af en temperaturgradient og en ladestrøm til en elektrisk -
 Forskere identificerer vigtige tendenser i blandingslag med høj energi-densitetVisualiseringer af et simuleret blandingslag med høj energi-densitet før reshock (venstre) og efter reshock (højre). Kredit:Lawrence Livermore National Laboratory Forestil dig en flaske salatdress
Forskere identificerer vigtige tendenser i blandingslag med høj energi-densitetVisualiseringer af et simuleret blandingslag med høj energi-densitet før reshock (venstre) og efter reshock (højre). Kredit:Lawrence Livermore National Laboratory Forestil dig en flaske salatdress -
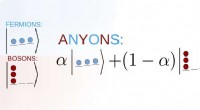 Ny tilgang til eksotisk kvantestofNår energiniveauerne i et kvantesystem er fyldt, fermioniske partikler udelukker hinanden, hvorimod bosonisk stof kan ophobes på det laveste niveau. I modsætning, nogen opfører sig på en mellemliggend
Ny tilgang til eksotisk kvantestofNår energiniveauerne i et kvantesystem er fyldt, fermioniske partikler udelukker hinanden, hvorimod bosonisk stof kan ophobes på det laveste niveau. I modsætning, nogen opfører sig på en mellemliggend -
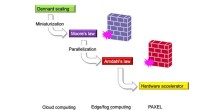 Brug lys til at fremskynde beregningenForskere i Japan har udviklet en type processor kaldet PAXEL, en enhed, der potentielt kan omgå Moores lov og øge computerens hastighed og effektivitet. I APL Photonics, forskerne kiggede på at bruge
Brug lys til at fremskynde beregningenForskere i Japan har udviklet en type processor kaldet PAXEL, en enhed, der potentielt kan omgå Moores lov og øge computerens hastighed og effektivitet. I APL Photonics, forskerne kiggede på at bruge
- Ingeniører rapporterer, at det foreslåede Mississippi-pumpeprojekt understøttes
- Stephen Hawkings arkiv, kontor erhvervet til britisk offentlighed
- Liste over fordelene ved friktion
- Nanodiamanter tager et stort skridt mod at bekæmpe kræft
- William Shatner, Tv kapt. Kirk, sprænger ud i rummet
- Hvad har et objekt i bevægelse, der har en tendens til at blive, hvad?


