Hvad er den stærkeste interpartikelkraft i en prøve af SO2?
Svovldioxid (SO2) er et polært molekyle, hvilket betyder, at det har en positiv ende og en negativ ende. Den positive ende af molekylet er svovlatomet, og den negative ende er oxygenatomet. Forskellen i elektronegativitet mellem svovl- og oxygenatomer skaber en delvis positiv ladning på svovlatomet og en delvis negativ ladning på oxygenatomet. Disse partielle ladninger tillader SO2-molekyler at tiltrække hinanden gennem dipol-dipol-kræfter.
Dipol-dipolkræfter er intermolekylære kræfter, der opstår mellem polære molekyler. De er forårsaget af tiltrækningen mellem den positive ende af et molekyle og den negative ende af et andet molekyle. Dipol-dipol-kræfter er svagere end hydrogenbindinger og ionbindinger, men de er stærkere end van der Waals-kræfter.
 Varme artikler
Varme artikler
-
 Skilsmisse i en endimensionel verdenGrafik A viser atomkæden i kvantesimulatoren som enkeltbilleder af en video. Tiden løber fra top til bund. På toppen kan du se den uforstyrrede kæde. I den anden position sparkes et atom ud. Holon (ly
Skilsmisse i en endimensionel verdenGrafik A viser atomkæden i kvantesimulatoren som enkeltbilleder af en video. Tiden løber fra top til bund. På toppen kan du se den uforstyrrede kæde. I den anden position sparkes et atom ud. Holon (ly -
 Letpresser reducerer kvantestøj i lasere, kunne forbedre kvanteberegning og gravitationsbølgedetek…Kredit:CC0 Public Domain Fysikere ved MIT har designet en kvante lys squeezer, der reducerer kvantestøj i en indkommende laserstråle med 15 procent. Det er det første system af sin art, der funger
Letpresser reducerer kvantestøj i lasere, kunne forbedre kvanteberegning og gravitationsbølgedetek…Kredit:CC0 Public Domain Fysikere ved MIT har designet en kvante lys squeezer, der reducerer kvantestøj i en indkommende laserstråle med 15 procent. Det er det første system af sin art, der funger -
 Gør lysenergi til varme for at bekæmpe sygdommeFøler nanopartiklernes størrelseafhængige lys-varme-konverteringseffektivitet ved hjælp af terahertz-stråling. Kredit:Roberto Morandotti En ny teknologi, der involverer små partikler, der absorber
Gør lysenergi til varme for at bekæmpe sygdommeFøler nanopartiklernes størrelseafhængige lys-varme-konverteringseffektivitet ved hjælp af terahertz-stråling. Kredit:Roberto Morandotti En ny teknologi, der involverer små partikler, der absorber -
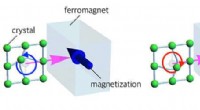 Kontrol af magnetisering ved overfladeakustiske bølgerSkematiske illustrationer af magnetiseringskontrol ved indsprøjtning af phonon -vinkelmoment. Kredit:Tohoku University Ved hjælp af den cirkulære vibration af overfladeakustiske bølger, en forskni
Kontrol af magnetisering ved overfladeakustiske bølgerSkematiske illustrationer af magnetiseringskontrol ved indsprøjtning af phonon -vinkelmoment. Kredit:Tohoku University Ved hjælp af den cirkulære vibration af overfladeakustiske bølger, en forskni
- Kan 2 NASA-astronauter sidde fast på rumstationen indtil næste år? En beslutning er nært forestå…
- Lyft suspenderer e-cykler efter batteri brænder
- Tutorial of How to Calculate Altitude & Temperature
- Små vandløb har en stor indflydelse på vores liv
- Hvordan konverterer jeg ampere til Kw 3-fase?
- BepiColombo skal målrettes midt i oktober


